1. 引言:头颈部癌的临床挑战与传统模型局限
头颈部癌(HNC)作为全球第六大常见恶性肿瘤,涵盖口腔癌、喉癌、鼻咽癌等多个亚型,其中头颈部鳞状细胞癌(HNSCC)占比最高,且存在 HPV 阳性与 HPV 阴性的显著异质性 ——HPV 阳性患者虽易发生淋巴结转移,但对放化疗敏感性更高,预后相对较好,而 HPV 阴性患者多与烟酒暴露相关,免疫浸润不足且治疗响应有限。当前 HNC 治疗以手术、放化疗及免疫检查点抑制剂(如 PD-1 抗体)为主,但近 50% 患者无法获益,且易出现局部复发或远处转移,核心问题在于传统研究模型难以精准模拟肿瘤微环境(TME)的复杂性。
传统 2D 细胞培养虽能实现 HNSCC 细胞系(如 UM-SCC-11B、FaDu)的低成本扩增,却无法还原细胞间通讯与 ECM(细胞外基质)相互作用,导致基因表达谱与体内肿瘤差异显著;患者来源异种移植(PDX)模型虽能部分模拟肿瘤生长,却存在小鼠基质替代人类基质、免疫微环境缺失及伦理争议等问题。这些局限推动了 3D 培养模型与器官芯片(OOC)技术的发展,而Chip、PDMS 芯片、3D Cell Culture Chip等技术的成熟,进一步为 HNC 研究提供了更贴近生理的解决方案。
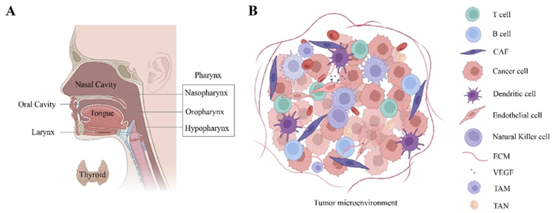
头颈部癌症及其复杂的微环境 A. 头颈部肿瘤最常见的部位包括:(1)口腔、(2)咽、(3)喉、(4)鼻腔和(5)甲状腺;B. 头颈部癌症(HNC)的肿瘤微环境(TME)由癌细胞、基质细胞(如癌相关成纤维细胞)、免疫细胞(如B细胞、T细胞、自然杀伤细胞)和细胞外基质(ECM)成分(如胶原蛋白、纤连蛋白)组成,这些成分共同与巨噬细胞相关;肿瘤相关中性粒细胞(TAN)支持肿瘤进展和治疗抵抗。缩写:CAF,癌相关成纤维细胞;VEGF,血管内皮生长因子;TAM,肿瘤
2. HNC 研究中 3D 模型的技术演进:从球状体到类器官
3D 模型的发展已从简单的肿瘤球状体迈向功能化类器官,逐步实现对 HNC 异质性与 TME 的模拟:
- 肿瘤球状体:基础 3D 模型的突破肿瘤球状体分为细胞系来源(MCTS)与组织来源两类。MCTS 通过 HNSCC 细胞系在 U 型底微孔板中悬浮培养形成,虽 histological 相似度有限,但能模拟肿瘤的代谢梯度与多细胞耐药性,适合初步药物筛选;而从 HNC 患者组织解离获得的球状体,因保留了肿瘤干细胞(CSCs)与 stromal 细胞,可更好反映原发肿瘤的异质性,尤其在评估 CSCs 相关耐药性时优势显著。这类模型常需搭配Chip实现动态培养,提升细胞活性与实验重复性。
- 肿瘤类器官:精准模拟 HNC 病理特征肿瘤类器官通过 Matrigel 结合生长因子(如 Wnt 激动剂、TGF-β 抑制剂)构建,可从患者新鲜肿瘤组织或诱导多能干细胞(iPSCs)分化而来。在鼻咽癌研究中,类器官模型成功解决了 EB 病毒(EBV)体外感染效率低的问题 —— 通过气液界面(ALI)培养结合PDMS 芯片的透气特性,EBV 感染率显著提升,为 HPV 阴性 HNC 的病毒致病机制研究提供了平台。此外,类器官微流控芯片能整合 CAFs(癌相关成纤维细胞)与免疫细胞,模拟 HNSCC 中 CAFs 分泌 IL-6、VEGF 促进血管生成的过程,而3D Cell Culture Chip的应用则进一步实现了类器官的长期动态培养与实时观察。
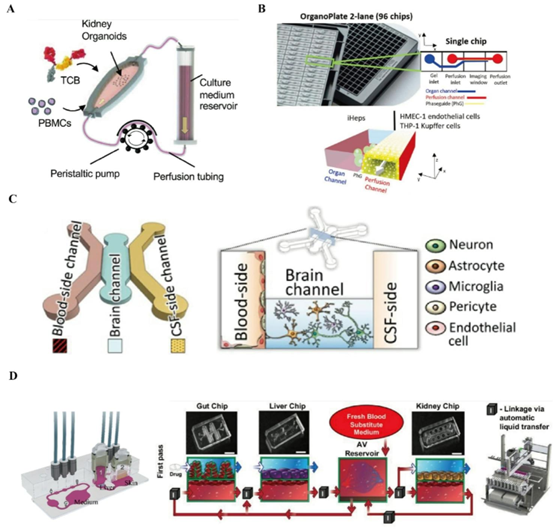
不同的器官芯片设计针对各种研究目的进行了定制(A)单腔室芯片设计。经许可转载[71]。版权所有2023,美国国家科学院院刊;(B)高通量多阵列芯片。经许可转载[72]。版权所有2021,毒理学;(C)平行腔室芯片。经许可转载[73]。版权所有2021,自然生物医学工程;(D)双器官和多器官互联芯片平台。经许可转载[74,75]。版权所有2018,科学报告;版权所有2020,自然生物医学工程
3. 器官芯片技术在 HNC 研究中的核心应用
器官芯片(OOC)通过微流控技术整合细胞、ECM 与物理微环境,成为突破 HNC 研究瓶颈的关键工具,其核心应用集中在三大方向:
1) 肿瘤微环境(TME)的精准复刻
HNC 的 TME 由肿瘤细胞、免疫细胞(T 细胞、巨噬细胞)、CAFs 及血管网络构成,器官芯片通过微流控加工与MEMS 加工技术实现多细胞共培养与动态灌注。例如,基于PDMS 芯片的 HNC 模型采用三层结构:顶层为口腔上皮细胞(模拟黏膜层),中层嵌入 CAFs 与胶原基质,底层为内皮细胞形成的血管通道,通过微流控泵实现培养基循环,精准模拟烟草烟雾或城市颗粒物(UPM)对呼吸道黏膜的损伤 —— 实验显示,UPM 暴露会降低 PDMS 芯片中上皮细胞的紧密连接蛋白 ZO-1 表达,破坏黏膜完整性,这与临床中烟酒相关 HNC 的黏膜损伤机制高度一致。
在材料选择上,PDMS 加工设备制作的芯片因可调节刚度(低至 100kPa)适合模拟软组织微环境,而搭配SU8 模具或光刻胶模具加工的微通道(直径 50-200μm),能实现 ECM 与细胞的精准分布;对于骨侵犯型 HNC(如下颌骨转移),则需在芯片中整合羟基磷灰石(HA)涂层支架,结合微纳加工平台提升骨基质模拟精度。
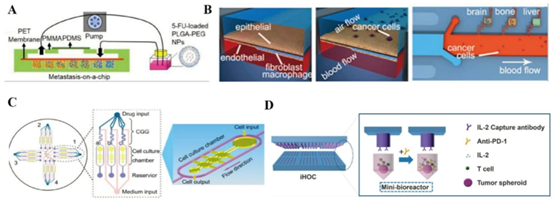
器官芯片在肿瘤转移和药物测试中的应用。(A)肾癌细胞Caki-1与癌相关成纤维细胞在仿生肝脏微环境芯片模型中的共培养。经许可转载[86]。版权所有2021,《治疗诊断学》;(B)多器官转移芯片模型。经许可转载[87]。版权所有2016,《ACS应用材料与界面》;(C)带有CGG的肺癌类器官药物测试模型,用于筛选患者来源的类器官并确定最佳药物浓度。经许可转载[89]。版权所有2013,《生物材料》;(D)一种高通量芯片模型,利用微柱阵列监测肿瘤-免疫相互作用,以测试抗PD-1对乳腺癌球状体和T细胞的作用。经许可转载[91]。版权所有2021,《Small》
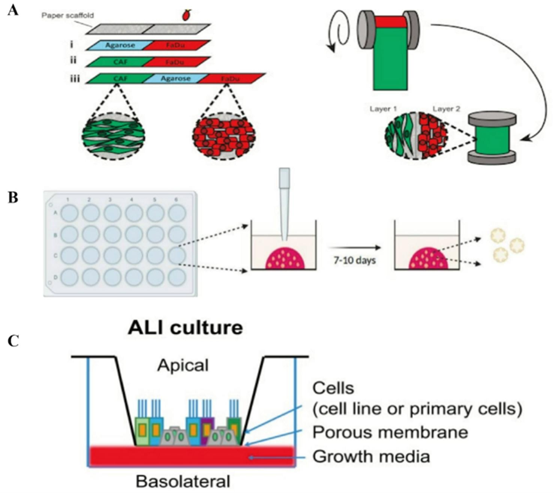
代表性头颈部癌(HNC)3D模型应用(A)癌症相关成纤维细胞与头颈部鳞状细胞癌细胞的3D TRACERs共培养模型。经许可转载[90]。版权所有2021,《生物材料》;(B)模拟肿瘤进展并测试基于纳米颗粒的药物递送系统的3D口腔癌模型。经许可转载[93]。版权所有2023,《在体》;(C)用于研究疾病进展和EB病毒感染的鼻咽癌气液界面3D培养模型。经许可转载[95]。版权所有2018,《mSphere》
2) HNC 转移过程的动态建模
淋巴结转移是 HPV 阳性 HNC 的典型特征,传统模型难以捕捉转移的动态过程,而转移器官芯片通过多腔室设计模拟 “原发灶 – 循环 – 继发灶” 路径。例如,甲状腺 – 肺转移芯片通过微流控光刻技术构建平行微通道,一侧培养甲状腺癌细胞(如 Caki-1),另一侧以肺 hydrogel 模拟靶器官,芯片中流动的培养基模拟血液循环 —— 研究发现,敲低 RCAN1.4 基因会通过上调 NFE2L3 促进癌细胞侵袭,且不同细胞系的转移能力差异可通过芯片实时观察。
这类模型的构建依赖器官芯片加工设备与Mcirofluidic Chip技术,例如采用紫外光刻机制作的微柱阵列,可量化癌细胞的迁移速度,而3D Cell Culture Chip中嵌入的淋巴内皮细胞,能分泌巨噬细胞迁移抑制因子(MIF),进一步揭示 HNC 细胞的糖酵解依赖机制,为抗转移药物研发提供靶点。
3) 个性化药物筛选与治疗评估
HNC 的异质性要求治疗方案个体化,器官芯片通过Mcirofluidic Chip实现高 – throughput 药物测试。例如,基于Chip的浓度梯度发生器(CGG),可在单芯片上生成 0.1-10μM 的药物浓度梯度,搭配患者来源 HNC 类器官,快速筛选化疗药物(如顺铂)或免疫抑制剂(如 PD-L1 抗体)的最佳剂量。在免疫治疗测试中,芯片还可整合健康供体的 PBMCs(外周血单核细胞),观察 IDO1 抑制剂对 T 细胞迁移的促进作用 —— 实验显示,这类Microfluidic cell culture chip能准确区分 HPV 阳性与阴性患者对 PD-1 抗体的响应差异,响应率与临床数据(15-20%)高度吻合。
此外,微流控芯片检测仪的应用实现了药物作用的实时监测,例如通过微电极阵列(MEA)记录 HNC 类器官的电生理信号,评估药物对肿瘤细胞活性的影响;而PDMS 模具制作的可重复芯片,降低了个性化测试的成本,为临床转化提供了可行性。
4. HNC 器官芯片的关键技术支撑与产业协同
器官芯片的性能依赖材料、加工与设备的协同,核心技术与产业资源的整合成为关键:
- 材料体系:从 PDMS 到功能化基质PDMS 芯片因光学透明、气体通透性好,成为 HNC 器官芯片的主流基材,通过PDMS 加工设备可实现刚度调节(添加固化剂比例);对于黏膜组织模拟,需结合脱细胞 ECM(dECM),如气管黏膜来源的 dECM,保留天然生化信号,支持上皮 – 内皮共培养;而SU8 模具与光刻胶模具则用于微通道的高精度加工,搭配光刻机(如 UV-KUB3)实现 5-10μm 的微结构分辨率,满足 MEMS 加工需求。
- 加工与设备整合微纳加工平台为芯片制造提供核心支撑,例如通过电子束光刻技术制作纳米级流道,模拟 HNC 中的微血管网络;微流控光刻技术则实现芯片与 3D 培养的结合,如在芯片表面光刻出细胞黏附位点,引导肿瘤细胞有序生长。产业端,微流控芯片代工企业(如苏州地区相关厂商)可提供从设计到量产的服务,而器官芯片加工设备的标准化(如模块化泵体、温控系统),则降低了实验室级芯片的应用门槛。
- 跨领域技术融合AI 与机器人技术的融入提升了芯片的自动化水平,例如通过机器视觉识别Chip中的肿瘤球状体大小,预测药物响应;机器人液体处理系统实现多芯片同步灌注,提升实验 throughput。此外,数字微流控芯片的发展,进一步简化了样品操作,适合临床场景下的快速检测。
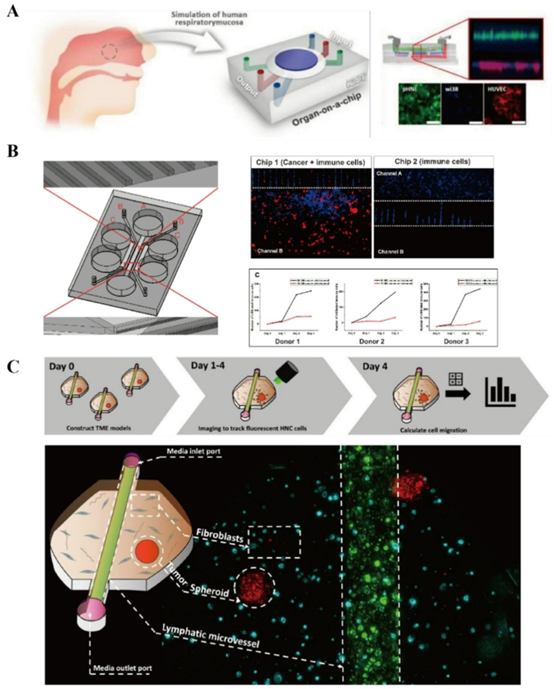
与头颈部癌症相关的代表性器官芯片研究(A)源自鼻腔的呼吸道芯片,由三层组成:上皮层、成纤维细胞层和内皮层。经许可转载[104];(B)用于舌癌的微流控芯片设计。免疫细胞加载在通道A中,舌癌细胞在通道B中,通道C用于水合作用。经许可转载[110];(C)模拟肿瘤微环境的口腔癌器官芯片,示意图及体外表征。经许可转载[112]
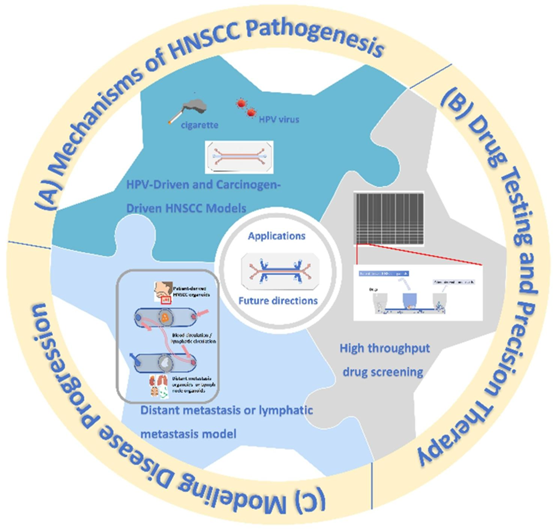
头颈部癌芯片肿瘤的构建策略
5. 当前挑战与未来发展方向
尽管器官芯片在 HNC 研究中取得突破,仍面临三大挑战:
- 标准化与重复性:不同实验室的芯片设计(如流道尺寸、材料配比)差异导致数据难以比对,需建立统一的Chip性能标准(如流体剪切力、细胞存活率),国际组织(如欧洲 Organ-on-Chip 协会)已启动相关工作;
- 临床转化效率:患者来源组织的处理流程复杂,芯片测试周期(通常 7-14 天)难以匹配临床治疗决策需求,需优化Mcirofluidic Chip流程,实现活检样本的快速芯片构建;
- 多器官协同模拟:HNC 转移涉及肺、骨等多器官,现有多器官芯片的血管连接技术尚不成熟,需进一步整合微流控系统与器官间物质交换机制。
未来方向上,HPV 特异性芯片将成为重点 —— 通过构建 HPV 阳性 / 阴性 HNC 的专属 TME 模型(如整合 HPV-16 E6/E7 基因的类器官),揭示病毒驱动的免疫逃逸机制;同时,organoid chip与 AI 的结合,可建立药物响应预测模型,推动个性化治疗方案的自动化生成。此外,Chip与影像技术(如共聚焦显微镜)的联用,将实现 TME 中细胞互作的实时可视化,为 HNC 发病机制研究提供新视角。
器官芯片技术与 3D 模型的发展,为头颈部癌研究提供了 “从实验室到临床” 的精准工具。通过PDMS 芯片、微流控加工、organoid chip等技术的整合,不仅解决了传统模型的局限,更实现了对 HNC 异质性、TME 复杂性的深度模拟。未来,随着标准化进程的推进与产业协同的加强,器官芯片将成为 HNC 药物研发、个性化治疗评估的核心平台,为提升患者生存率与治疗质量提供关键支撑,推动头颈部癌研究进入 “精准微生理” 时代。
参考文献:https://doi.org/10.1186/s12967-025-06824-5
Dxfluidics Products
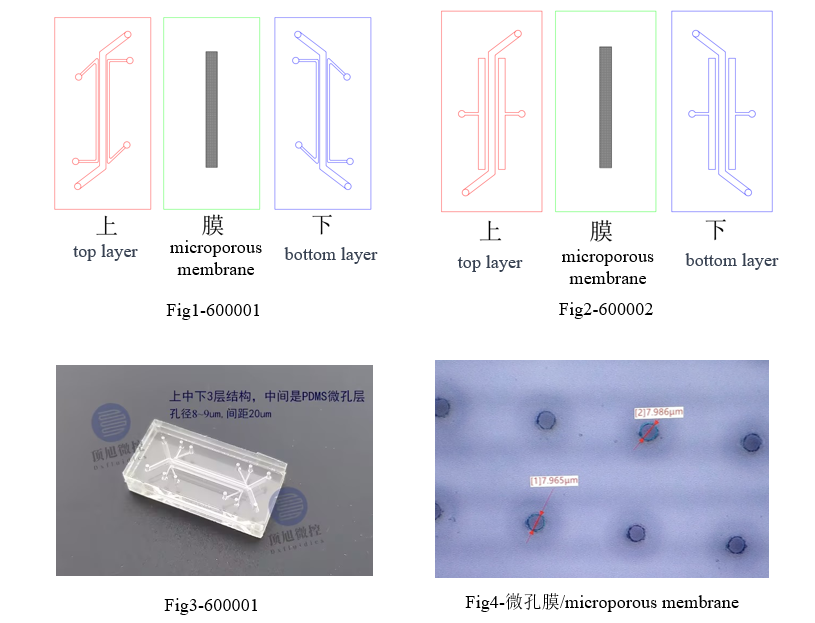
| Product Code | Outline (mm) | Channel | Microporous membrane | Material | Price (CNY) | |||
| Height (mm) | Width (mm) | Space (mm) | Thickness (um) | Hole diameter (um) | ||||
| 600001 | 30*15 | 0.5 | 1 | 0.2 | 25 | 8 | PDMS | 800 |
| 600002 | 30*15 | 0.5 | 1 | 0.5 | 25 | 8 | PDMS | 800 |
Ordering Methods



© 2026. All Rights Reserved. 苏ICP备2022036544号-1













