1. 引言
微流控技术作为精准操控微米尺度流体的核心技术,近年来在生物医学与药物研发领域展现出革命性潜力。从早期用于 DNA 测序、聚合酶链反应扩增,到如今成为器官芯片、细胞培养芯片的核心支撑技术,微流控凭借其独特的流体操控能力,已成为药物释放颗粒制造的优选方案。依托 MEMS 加工、微纳加工平台的技术赋能,微流控芯片能够精准调控粒子尺寸、成分与释放特性,解决了传统制造方法中粒子均一性差、药物封装效率低等痛点。如今,随着 PDMS 芯片、玻璃微流控芯片、COC 微流控芯片等多样化器件的研发,以及光刻、阳极键合、深硅刻蚀等加工工艺的升级,微流控技术正逐步从实验室走向工业应用,为靶向给药、长效释药等高端医疗需求提供了全新解决方案。
2. 微流控器件的设计核心与加工技术
1) 器件结构设计与功能实现
微流控器件的核心设计围绕流体操控效率展开,主流结构包括流动聚焦几何结构、T 型结与同轴几何结构。流动聚焦几何结构通过连续相对分散相的双向挤压形成液滴,其 2D 结构因加工简便成为药物释放颗粒制造的首选,可通过调整通道夹角(45°-90°)精准控制粒子尺寸,适配 PLGA、PCL 等聚合物材料的加工需求。T 型结结构则利用垂直通道的剪切力形成液滴,虽混合效率较高,但在 PDMS 芯片中易因材料柔性导致粒子形状不规则,更适用于玻璃、激光橡胶等刚性器件。同轴几何结构采用嵌套毛细管设计,实现三维方向的流体包裹,特别适合纳米级药物颗粒的制备,其无器件表面接触的特性的提升了脂质体、磁性纳米粒子的封装稳定性。

在流动聚焦交叉口处的形成。两相在十字形交叉口相遇,图1为微流控装置中最常用的液滴制备设计。a) 连续相从上下两侧将分散相夹断形成液滴。b) T型交叉口处的液滴形成,两相在T型交叉口相遇,连续相产生的剪切应力导致液滴形成。c) 利用同轴几何结构形成液滴,连续相在三维空间中完全包围分散相以产生液滴。
此外,为解决微流控系统的混合效率问题,交错人字形混合器(SHM)等被动混合结构被广泛应用,通过增加流体接触面积加速扩散混合,配合 PDMS 键合对准平台的精准定位,可实现多组分药物的均匀封装。针对量产需求,平行化设计已成为关键突破方向,364 个 T 型结或 1200 个流动聚焦 junction 的并行器件,能够将粒子生产速率提升至工业级水平,为微流控代工、芯片定制提供了技术支撑。
2) 核心加工工艺与设备支撑
微流控器件的加工依赖成熟的微纳制造技术体系。光刻技术作为基础工艺,通过 SU8 光刻胶模具的制备,实现微通道的高精度复刻,配合紫外光刻机、接触式光刻机等设备,可获得尺寸精度达微米级的通道结构。PDMS 芯片的加工采用软光刻工艺,将液态 PDMS 浇筑于光刻胶模具中,经烘箱固化、PDMS 打孔器开孔、等离子键合等步骤完成器件组装,其低成本、高弹性的特性使其成为实验室研发的主流选择。
对于工业级应用,热塑性材料(PMMA、COC、PTFE)的加工依赖注塑成型、热压印等工艺,其中 PMMA 芯片通过注塑模具批量生产,配合激光 ablation 技术实现通道精细修饰,在生物相容性与机械稳定性上表现优异。玻璃微流控芯片则采用湿蚀刻、阳极键合工艺,具备良好的溶剂兼容性与光学透明度,适合需要实时观测粒子形成过程的场景。MEMS 加工技术的融入进一步提升了器件性能,通过电子束光刻、薄膜镀膜等工艺,可在芯片上集成微阀、微泵等功能单元,实现流体的自动化操控。
3. 微流控制造的核心材料特性与应用场景
1) 主流材料分类与性能对比
微流控器件的材料选择直接影响药物释放颗粒的质量与稳定性。PDMS 作为最常用的弹性材料,具有良好的气体通透性、易键合特性,可通过 PDMS 工作站实现多通道器件的快速组装,但溶剂兼容性差、易吸附蛋白质的缺点限制了其在部分药物体系中的应用。玻璃材料凭借优异的化学稳定性、热稳定性与光学透明度,成为有机溶剂体系、高温反应场景的优选,其与硅的复合结构可通过深硅刻蚀工艺实现高 aspect ratio 通道加工,适配复杂粒子的制备需求。
热塑性材料中,COC、PTFE 具备极强的化学抗性,可耐受强溶剂腐蚀,适合制备需要长期储存的药物颗粒;PMMA 芯片则以低成本、易加工的优势,在 POCT 微流控芯片、一次性器件中广泛应用。此外,生物相容性材料的研发成为热点,壳聚糖、明胶等天然聚合物通过表面修饰(PEG 修饰、氨基修饰)提升生物相容性,配合亲水修饰工艺降低药物吸附,为蛋白质、核酸类药物的封装提供了保障。
2) 材料与药物体系的适配性
不同药物体系对微流控材料的需求存在显著差异。对于疏水性药物(如紫杉醇、姜黄素),PDMS 芯片与 PLGA、PCL 等聚合物的兼容性良好,可通过油包水乳液体系实现高效封装;而水溶性药物则更适合玻璃微流控芯片或 COC 微流控芯片,避免因材料吸附导致的药物损失。磁性药物颗粒的制备常采用同轴几何结构的玻璃器件,通过分散相中的磁粉均匀分散,配合外部磁场调控,实现靶向给药功能。
在疫苗研发领域,mRNA 脂质纳米粒子(LNP)的制造成为微流控技术的重要应用场景,利用 PDMS 微流控芯片的精准流体操控,可实现脂质体与 mRNA 的高效复合,其制备的粒子尺寸均一性高,能显著提升疫苗的免疫原性。此外,pH 响应型、温度响应型粒子的制备,通过在 PDMS 芯片或玻璃芯片中引入智能聚合物,配合表面电荷修饰,实现药物在病灶部位的定点释放。
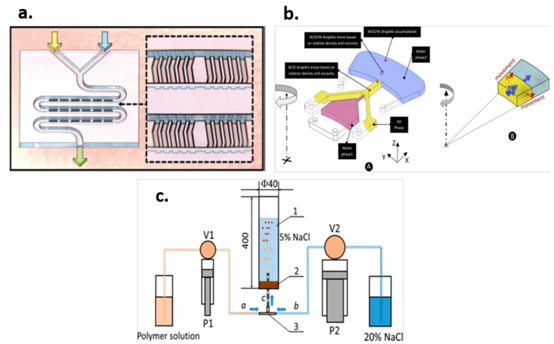
图2. 用于制备药物释放颗粒的微流控器件特征示例。a) 带有交错人字形混合器(SHM)的微流控器件,分别用于制备聚合物溶液,随后是一组SHM,绿色箭头指示纳米颗粒流出的器件出口。插图显示了通道中SHM的细节。经CSIRO Publishing许可转载自[95];经版权清算中心许可转载。黄色和蓝色箭头分别显示水相和载药PLGA纳米颗粒的注入。b) 设计用于安装在旋转平台上进行泵送的微流控器件示意图,该器件用于形成海藻酸盐药物释放微颗粒。在流动聚焦 junction 处形成水/油/水液滴,分散相(水)显示为粉色,第一包封相显示为黄色(油),第二包封相显示为蓝色(水),插图显示了作用在各相上的离心力方向。经Elsevier许可转载自[98]。c) 使用玻璃溶解柱制作的微流控器件示意图,用于形成多种聚合物药物释放微颗粒,其中P1-V1和P2-V2分别代表每个相的泵送-阀控系统对;a、b和c分别显示聚合物、水相和乳液的流动方向;1和2是溶解柱和控制流动方向的 stopper。经[99]许可转载。版权所有2017美国化学会。
4. 微流控技术的核心优势与工业转化挑战
1) 技术优势与应用价值
相较于传统制造方法(批量搅拌、乳化、溶剂蒸发),微流控技术具有三大核心优势:一是粒子均一性高,通过调控流速比、通道尺寸,可实现变异系数(CV)小于 5% 的单分散粒子制备,解决了传统方法中粒子尺寸分布宽导致的释药速率不稳定问题;二是药物封装效率高,利用液滴的精准包裹特性,PLGA、PCL 等聚合物的药物负载率可提升至 98%,尤其适用于生物活性药物的高效保留;三是材料消耗低,试剂用量仅为传统方法的 1/100-1/1000,降低了高价值药物的研发成本。
在应用场景上,微流控技术制造的粒子可实现多重功能集成,如磁响应性 + pH 响应性的复合粒子,能够穿透血脑屏障、靶向肿瘤组织,为癌症、神经退行性疾病的治疗提供新路径。类器官芯片、3D 细胞培养芯片与微流控释药系统的结合,可构建体外药物筛选模型,精准模拟药物在体内的释放与作用过程,加速新药研发进程。
2) 工业转化的核心挑战
尽管实验室成果显著,微流控技术的工业转化仍面临三大瓶颈:一是量产能力不足,单通道器件的粒子生产速率仅为 0.1-10 mL/h,虽可通过平行化设计提升产量,但液压阻力不均、压力波动等问题影响粒子均一性;二是加工成本高,玻璃芯片、COC 芯片的批量生产依赖昂贵的光刻设备、注塑模具,PDMS 芯片的手工组装效率低,难以满足大规模生产需求;三是材料兼容性限制,PDMS 对有机溶剂的敏感性、热塑性材料的阀门集成难题,制约了部分高活性药物的加工。
此外,工业应用对器件的稳定性与重复性要求严苛,微流控芯片的长期使用中易出现通道堵塞、键合失效等问题,需要通过表面防粘层修饰、长效亲水处理等工艺优化。同时,微流控设备与现有制药生产线的适配性不足,缺乏标准化的接口与控制体系,也延缓了技术落地进程。
5. 未来发展方向与技术突破点
1) 器件功能与材料创新
未来微流控技术将向多功能集成方向发展,通过在芯片上集成微传感器、微加热器、磁场发生器等单元,实现药物释放的实时监测与精准调控。例如,结合微电极阵列的微流控芯片,可通过电信号反馈调整粒子释放速率;融入磁珠的器件则能实现药物的靶向富集。材料方面,新型抗生物污染涂层的研发将解决蛋白质吸附问题,而自修复材料的应用可提升器件使用寿命,降低工业生产成本。
在粒子设计上,多腔室、Janus 结构的复合粒子将成为研究热点,通过微流控芯片的分层包裹技术,实现多种药物的协同释放,适配联合治疗需求。同时,天然聚合物与无机材料的复合(如 PLGA/TiO2)将提升粒子的机械强度与生物相容性,拓展在组织工程、再生医学中的应用。
2) 量产技术与工业适配
量产能力的提升将依赖加工工艺的规模化升级,3D 打印技术的融入可缩短模具制备周期,降低定制化器件的研发成本,尤其适合小批量、多品种的药物颗粒生产。此外,模块化设计的推广将实现微流控芯片的快速组装与更换,配合标准化的 PDMS 加工设备、芯片切割设备,可构建柔性生产线,适配不同药物体系的制造需求。
工业适配方面,微流控系统将与连续流反应、在线检测等技术整合,形成 “制造 – 监测 – 调控” 的闭环体系。通过微流控分配器芯片、液滴生成芯片的标准化设计,实现与现有制药设备的无缝对接。同时,成本控制将成为关键突破点,通过注塑成型、卷对卷加工等批量工艺的优化,降低 PDMS 芯片、PMMA 芯片的单位成本,推动微流控技术在 generic 药物领域的普及。
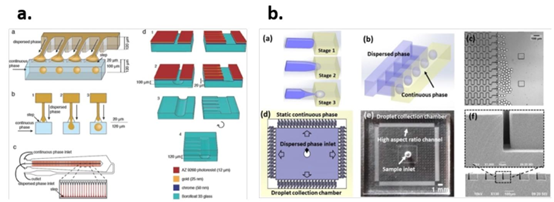
图3. 用于大规模生产药物释放颗粒的微流控装置。a)使用玻璃微流控装置将364个T型接头并行化以形成药物释放微粒,其中(a)和(b)展示了接头处液滴形成的示意图(分别为侧视图和俯视图),(c)是完整微流控装置的直观图示,每条红线代表一个单独的T型接头,(d)展示了微流控装置的分步制造过程。经John Wiley and Sons许可,转载自[106]。b)在多层微流控装置中并行化1200个流动聚焦接头;其中(a)和(b)展示了液滴形成机制的不同视图;(c)展示了高通量下液滴形成的图像;(d)展示了装置的示意图,其中分散相(蓝色)从四个方向注入装置中心,静态连续相(黄色)环绕微流控装置;(e)展示了微流控装置的对应照片,(f)是通道横截面的扫描电子显微镜(SEM)图像。根据知识共享署名4.0国际公共许可协议,转载自[46]。
3) 政策与市场驱动下的技术落地
随着全球制药行业对靶向给药、精准医疗的需求增长,微流控技术已成为生物医药领域的投资热点。mRNA 疫苗生产中,微流控制备的脂质纳米粒子展现出高效的抗原递送能力, Pfizer、Moderna 等企业的技术应用验证了其工业可行性。国内政策对微纳制造、生物芯片产业的扶持,也加速了微流控芯片厂家、微流控代工企业的技术迭代,苏州、江苏等地的产业集群已形成从芯片设计、加工到系统集成的完整产业链。
未来,随着药监局对微流控制造技术的规范出台,以及标准化检测方法的建立,微流控药物释放颗粒将逐步获得市场认可。预计在肿瘤治疗、神经疾病治疗、疫苗研发等领域,微流控技术将实现规模化应用,成为高端制药产业的核心支撑技术。
微流控技术凭借其精准的流体操控能力、高效的药物封装效率,已成为药物释放颗粒制造的革命性技术。从 PDMS 芯片、玻璃微流控芯片的多样化器件,到光刻、MEMS 加工、平行化制造的工艺升级,微流控技术不断突破性能与量产的双重瓶颈。尽管目前仍面临工业转化成本高、材料兼容性有限等挑战,但在技术创新与市场需求的双重驱动下,其在靶向给药、长效释药等领域的应用前景广阔。未来,随着微流控芯片设计的优化、加工工艺的成熟以及产业链的完善,该技术将彻底改变药物制造的格局,为人类健康提供更精准、更高效的医疗解决方案,推动生物医药产业向高质量发展迈进。
参考文献:https://doi.org/10.1016/j.jconrel.2021.03.019
© 2026. All Rights Reserved. 苏ICP备2022036544号-1













