1. 引言:治疗性 EVs 的潜力与制造瓶颈
细胞外囊泡(EVs)作为天然的细胞间通信载体,凭借低免疫原性、高效 cargo 递送能力,在肿瘤治疗、组织修复、免疫调节等领域展现出巨大治疗潜力。近年来,全球 EVs 相关临床试验持续增长,覆盖 61 种疾病,但传统制造流程存在产量低、纯度不足、规模化困难等痛点,严重制约临床转化。微流控技术以其精准的流体操控、高集成度和可控性,成为突破 EVs 制造瓶颈的核心方案,结合 PDMS 加工、MEMS 加工、光刻等关键技术,构建起从生产到质控的全流程解决方案,为治疗性 EVs 的产业化奠定基础。
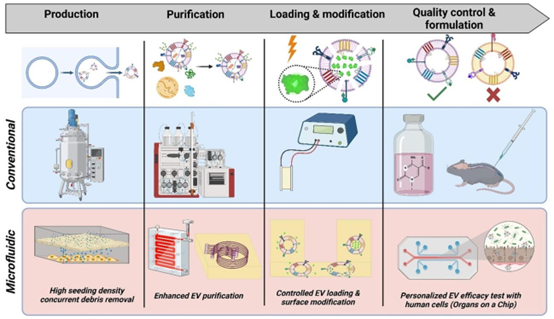
图1 传统细胞外囊泡(EV)制造流程示意图(从左到右),包括在生物反应器中培养的细胞产生EV,随后进行澄清,使用切向流过滤(TFF)和尺寸排阻色谱(SEC)进行纯化,使用电穿孔等系统(如图所示)进行加载和修饰,之后进行质量控制和制剂配制。微流控系统(从左到右)可在每个步骤中提高该流程的性能,具体表现为提高EV产品纯度、加载和表面修饰效果,以及在质量控制环节的提升。
2. 微流控技术在 EVs 制造全流程的核心应用
1) 微流控生物反应器:高效 EVs 生产的核心载体
传统 EVs 生产依赖 T 型瓶、 spinner flask 等设备,存在细胞密度低、剪切应力不均、营养供应不足等问题。基于 PDMS 的微流控生物反应器通过优化通道设计(如 200μm×5μm PDMS 微通道),实现细胞的高密度 3D 培养,结合持续灌注系统精准调控 pH、氧分压和营养供应,显著提升 EV 产量与质量。研究表明,在 0.5-5 dyn/cm² 的温和剪切应力下,牙髓来源间充质干细胞的 EV 产量可提升 24 倍,而 PDMS 微流控芯片的高比表面积特性,能减少培养基消耗 30% 以上,降低生产成本。
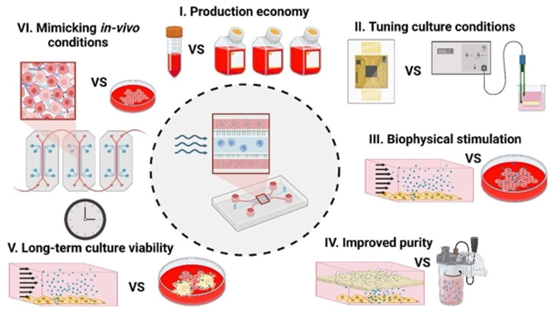
图2 微流控细胞外囊泡(EV)生产相较于传统培养的优势包括:(A)通过最大限度减少培养基和试剂的使用实现生产经济性;(B)利用集成传感器调节培养条件,实时监测温度、溶解氧和pH等条件;(C)利用可控剪切力施加生物物理刺激;(D)通过生物反应器中嵌入的膜过滤提高纯度;(E)通过灌注培养、清除废物和供应新鲜培养基实现长期培养活力;(F)通过3D培养重现体内微生理条件。
针对不同细胞类型的培养需求,微流控生物反应器可整合器官芯片设计理念,构建类体内微环境。例如,3D 细胞培养芯片通过形成细胞球体,利用缺氧诱导和细胞间紧密相互作用,进一步增强 EVs 的分泌效率,同时保留其生物活性。此外,MEMS 加工技术打造的微结构支架,能为细胞提供稳定的附着位点,减少剪切应力对细胞的损伤,保障 EVs 的功能完整性。
2) 高精度纯化:微流控技术提升 EVs 纯度与回收率
EVs 纯化是制造流程的关键环节,传统离心、过滤方法存在纯度低、损失大等问题。微流控系统结合 MEMS 加工的微滤膜、光刻胶模具,实现多机制协同纯化,大幅提升分离效率。基于尺寸筛选的微流控过滤系统,利用 600nm 和 20nm 双孔径 PDMS 过滤膜,可高效去除细胞碎片、蛋白聚集体等杂质;免疫惯性分选技术则通过修饰 CD9、CD63 抗体的微柱阵列,特异性捕获目标 EVs,纯度可达 90% 以上。
针对规模化生产需求,ExoTFF 等混合纯化平台整合电动力学过滤与切向流过滤(TFF),处理 500mL 样品仅需 45 分钟,EV 回收率超 80%,同时去除 99% 以上的杂蛋白。此外,基于表面修饰技术的亲和捕获方案,通过醛基化、氨基化修饰的微通道表面,实现 EVs 的特异性结合与温和释放,避免传统方法对 EV 膜结构的破坏。
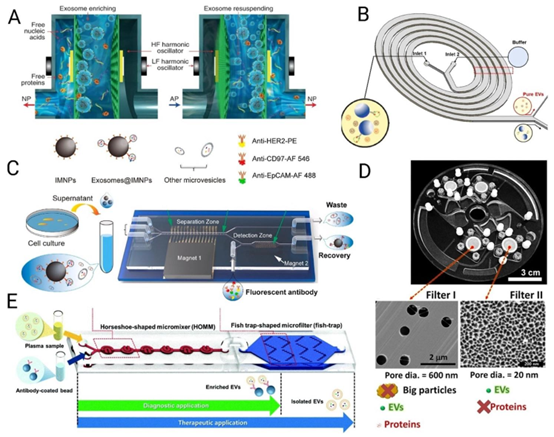
图3 可扩展微流控细胞外囊泡(EV)纯化(A)Exodus,转载自(Chen等人,2021年),经施普林格·自然许可;(B)负惯性,转载自(Kwon等人,2025年),经爱思唯尔许可;(C)免疫磁分离,转载自(Yu等人,2021年),经爱思唯尔许可;(D)外泌体圆盘,转载自(Woo等人,2017年),经美国化学会许可;以及(E)免疫捕获纯化,转载自(Gwak等人,2022年),经英国皇家化学会许可。
3) 精准装载与表面修饰:增强 EVs 治疗靶向性

图4 使用以下方法进行的微流控细胞外囊泡(EV)加载:(A)细胞纳米穿孔(CNP)生物芯片,转载自(Yang等人,2020年),经施普林格·自然出版社许可;(B)微流控超声处理,转载自(Liu等人,2019年),经美国化学会许可;(C)剪切诱导的小细胞外囊泡纳米穿孔(ENP)装置,转载自(Hao等人,2021年),经约翰·威利父子出版社许可。
EVs 的治疗效果依赖于高效的 cargo 装载和靶向修饰,微流控技术通过精准操控流体与反应条件,解决传统方法装载效率低、修饰不均的问题。微流控电穿孔技术利用 30,000 个纳米通道产生的局部电场,实现 mRNA、化疗药物等 cargo 的高效装载,其中 DNA 质粒的 mRNA 装载效率提升 1000 倍,每颗 EV 可携带 2-10 个完整 mRNA 分子。
表面修饰方面,微流控脂质插入技术通过快速混合实现 PEG 化脂质与 EV 膜的高效整合,修饰时间不足 2 分钟,显著提升 EVs 的体内循环时间;点击化学与光控释放技术则可实现肿瘤抗原肽、靶向配体的精准偶联,如将 gp-100、MART-1 等抗原肽修饰于 EV 表面,增强免疫治疗效果。这些修饰策略与表面修饰技术中的环氧基修饰、PEG 修饰等工艺一脉相承,为 EVs 的功能化提供了多样化解决方案。

图5 通过(A)芯片上脂质插入对细胞外囊泡(EV)进行微流控表面修饰,经Elsevier许可转载自(Geng等人,2024年);(B)使用光可切割连接体在芯片上与磁性捕获珠结合,经皇家化学会许可转载自(Zhao等人,2019年)。
4) 实时质控:微流控芯片保障 EVs 质量一致性
治疗性 EVs 的临床转化需要严格的质量控制,微流控芯片凭借高灵敏度和集成性,实现 EVs 尺寸、纯度、生物活性的实时监测。基于荧光扩散 sizing 的微流控系统,可在几分钟内完成 EVs 尺寸(50-200nm)、浓度及 CD63 等标志物的同步检测,样品消耗量仅需 5μL;微流控化学发光 ELISA 芯片则能直接从细胞培养上清中定量检测 CD9、EGFR 等标志物,检测下限低至 8.7×10⁷ EVs/mL。
在生物活性验证方面,器官芯片与微流控技术的结合成为关键手段。肝器官芯片、肾器官芯片可模拟体内微环境,评估 EVs 的靶向分布与治疗效果,如 MSC 来源 EVs 在糖尿病伤口愈合模型中,能使 CD31⁺内皮细胞数量显著增加,加速血管再生。此外,微流控芯片还可监测 EVs 的细胞摄取效率,确保其在靶细胞内有效释放 cargo。
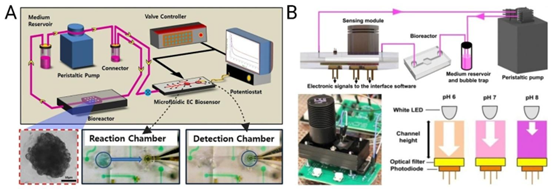
图6 生产阶段用于评估制造的细胞外囊泡(EVs)质量控制的微流控技术。(A)一种用于监测对乙酰氨基酚(APAP)作用下肝细胞培养物代谢活性的微流控电化学传感器,转载自(Riahi等人,2016年),遵循知识共享署名4.0国际许可协议;(B)一种与微流控生物反应器传感器集成的多分析物pH和氧气系统,经AIP出版社许可转载自(Mousavi Shaegh等人,2016年)。
3. 核心技术与材料支撑:微流控 EVs 制造的基础
1) PDMS 材料与加工工艺
PDMS(聚二甲基硅氧烷)作为微流控芯片的核心材料,凭借良好的生物相容性、透气性和易加工性,广泛应用于 EVs 生产、纯化和装载芯片。PDMS 微通道的制备依赖光刻与模塑工艺,通过光刻胶模具(如 SU8 光刻胶)制作微结构模板,再经 PDMS 浇筑、固化成型,可实现微米级通道精度控制。针对 EVs 制造需求,PDMS 芯片可进一步进行表面修饰(如等离子体处理、PEG 修饰),减少 EVs 吸附损失,提升分离与装载效率。
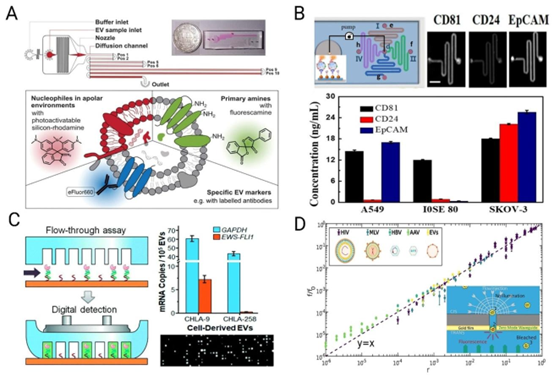
图7 利用微流控技术对所产生的细胞外囊泡(EVs)进行生物物理和生化质量控制(QC)(A)基于荧光的微流控扩散 sizing(fluoMDS),可实现EV的大小、形态和分子谱分析,经John Wiley and Sons许可,转载自(Paganini等人,2022年);(B)用于多重EV蛋白生物标志物分析的微流控免疫测定(此处为CD81、CD24和EpCAM,三个插图显示检测微孔的荧光图像,经英国皇家化学会许可,转载自(Zhang等人,2018年)。(D)使用流体动力学纳米孔系统进行病原体检测和病毒安全性测量。多种病毒(HIV、MLV、HBV和AAV)作为图案化微流控数字分析芯片,用于无PCR检测细胞培养衍生的GAPDH和EWS-FLI1 Type 1的EV mRNA;黑白不同细胞系)-插图显示夹心测定,经美国化学会许可,转载自(Zhou等人,2020年);(C)微孔,因为EV是根据其通过纳米孔的易位频率来检测的,经美国化学会许可,转载自(Chazot-Franguiadakis等人,2022年)。
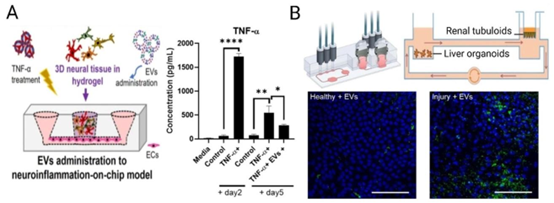
图8 利用微流控技术对人工制备的细胞外囊泡(EVs)进行功能表征:(A)利用芯片器官疾病模型研究治疗效力和作用机制——在此,评估了间充质基质细胞(MSC)来源的EVs在神经细胞分化和神经组织形成方面的作用,MSC来源的EVs的抗炎作用体现在肿瘤坏死因子-α(TNF-α)分泌的减少,经Springer Nature许可转载自(Saglam-Metiner等人,2024年);(B)整合肾脏和肝脏类器官的EVs循环与积累多器官微流控模型;MSC来源的EVs选择性地在受损肾脏组织中积累,根据知识共享署名许可(CC BY)转载自(Nguyen等人,2022年)。
2) MEMS 加工与光刻技术
MEMS(微机电系统)加工技术为微流控芯片的高精度结构提供保障,包括光刻、刻蚀、镀膜等工艺。光刻技术通过紫外光曝光实现微结构图案转移,是制作微滤膜、微柱阵列的关键步骤;深硅刻蚀工艺可打造高 aspect ratio 的微通道,增强流体操控能力;而电子束光刻则能实现纳米级结构加工,满足 EVs 分选的高精度需求。这些工艺与微流控芯片的结合,使 EVs 制造设备的集成度和性能大幅提升。
3) 表面修饰与功能化技术
表面修饰技术是提升微流控芯片性能的关键,包括醛基化修饰、氨基化修饰、环氧基修饰等。通过这些修饰,芯片表面可固定特异性抗体、配体或生物分子,实现 EVs 的特异性捕获、 cargo 装载或靶向修饰。例如,醛基修饰的载玻片可用于 EVs 的高效捕获与检测,氨基修饰的微通道则能增强脂质体与 EV 膜的结合效率,为功能化修饰提供稳定界面。
4. 行业挑战与解决方案
1) 规模化生产与无菌性控制
微流控技术的规模化应用面临通道堵塞、产量不足、无菌性难以保障等问题。解决方案包括:采用并行化 PDMS 芯片设计,将单芯片 throughput 提升至 1-2 L/h;集成在线灭菌模块(如 UV-C 照射、超临界 CO₂灭菌),避免污染风险;优化微通道结构(如鱼骨型、人字形),减少蛋白吸附与堵塞。例如,Exodus T-2800 系统通过双膜纳米过滤与超声振荡技术,实现 10L MSC 培养基的 EVs 分离,纯度达 10⁸ particles/μg 蛋白。
2) 技术标准化与成本控制
当前 EVs 制造缺乏统一标准,微流控设备成本较高。行业趋势是发展模块化、一次性 PDMS 芯片,降低设备投资;制定 EVs 尺寸(50-150nm)、纯度(粒子 / 蛋白比≥10¹⁰)等关键指标的行业标准;整合 AI 算法实现工艺参数的实时优化,提升批间一致性。此外,MEMS 加工工艺的规模化应用可降低芯片制造成本,推动微流控技术的普及。
5. 未来趋势:微流控与 EVs 制造的深度融合
1) AI 驱动的智能化制造
AI 与微流控技术的结合将实现 EVs 制造的全流程自动化,通过机器学习算法优化剪切应力、流速等参数,预测 EV 产量与质量;实时监测系统与反馈控制模块联动,自动调整工艺条件,保障产品一致性。例如,AI 算法可分析 EVs 尺寸分布数据,动态调整微流控芯片的过滤参数,提升纯化效率。
2) 个性化与精准治疗
基于微流控的个性化 EVs 制造将成为趋势,通过患者来源的细胞培养芯片生产定制化 EVs,结合器官芯片进行疗效预测;利用微流控技术实现 EVs 的按需装载与修饰,针对不同疾病类型优化 cargo 组合与靶向策略。例如,针对肿瘤患者的个性化 EVs 疗法,可通过微流控芯片装载化疗药物与免疫检查点抑制剂,提升治疗特异性。
3) 多技术交叉融合
微流控技术将与基因编辑、3D 打印、器官芯片等技术深度融合,打造一体化 EVs 制造平台。例如,CRISPR-Cas9 修饰的细胞通过微流控生物反应器生产 EVs,3D 打印的器官芯片用于疗效验证,形成 “生产 – 修饰 – 质控 – 验证” 的闭环系统,加速 EVs 的临床转化。
微流控技术凭借精准的流体操控、高集成度和兼容性,已成为治疗性 EVs 制造的核心支撑技术。结合 PDMS 加工、MEMS 加工、光刻、表面修饰等关键工艺,微流控系统实现了 EVs 生产、纯化、装载修饰与质控的全流程优化,大幅提升产品产量、纯度与一致性。尽管面临规模化、标准化等挑战,但随着 AI 整合、个性化制造等技术的发展,微流控赋能的 EVs 制造将逐步突破瓶颈,推动 EVs 疗法从临床试验走向产业化,为精准医疗提供全新解决方案。未来,微流控芯片与器官芯片、基因编辑等技术的深度融合,将进一步拓展治疗性 EVs 的应用边界,引领生物制药行业的新变革。
参考文献:https://doi.org/10.1002/jev2.70132
© 2026. All Rights Reserved. 苏ICP备2022036544号-1













