1. 引言
微流控技术作为微纳制造领域的核心技术之一,凭借其微型化、高吞吐量、低试剂消耗等优势,已在生物培养、药物递送、分子检测等多个领域实现突破性应用。其中,液滴基微流控芯片通过精准操控离散微液滴,为功能性微球的制备提供了高效平台,而 MEMS 加工技术的成熟的进一步推动了微流控芯片结构设计的精细化与标准化。在微藻培养领域,传统宏观培养方法存在污染风险高、培养条件难调控等问题,而微流控芯片的出现实现了培养过程的微型化与精准化,为微藻生物质的高效获取提供了新路径。
海藻酸钙水凝胶微球因具备良好的生物相容性、高交联网络结构及优异的物质保留能力,成为细胞封装与培养的理想载体。传统制备方法多采用内部凝胶化技术,但易出现微流控芯片通道堵塞、凝胶化不均等问题,限制了其规模化应用。基于此,澳大利亚格里菲斯大学研究团队提出将外部凝胶化技术与液滴基微流控芯片相结合,成功实现小球藻的高效封装与稳定培养,该技术不仅优化了水凝胶微球的制备工艺,更拓展了微流控芯片在微生物培养领域的应用边界,为类器官芯片、3D 细胞培养芯片等相关产品的研发提供了重要参考。
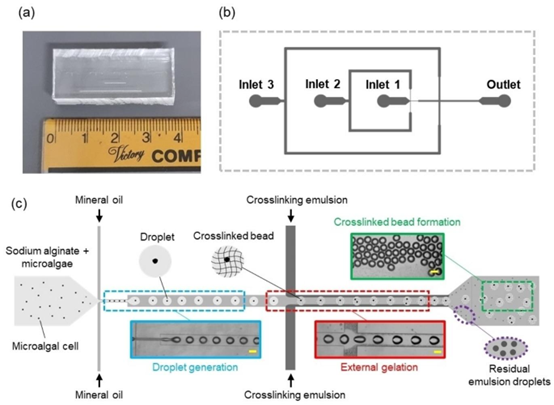
图1. 用于生成海藻酸钙水凝胶微球的微流控装置:(a)微流控装置的实物图;(b)具有3个入口、1个出口的微通道设计,第一个 junction 后,第二个 junction 后进行外部凝胶化,在出口处形成交联微球。比例尺代表100 μm;(c)包裹微藻的海藻酸钙水凝胶微球的微流控生成示意图,包括之后的液滴生成
2. 技术原理与核心制备工艺
1) 微流控芯片设计与制备
该研究采用软光刻技术制备 PDMS 微流控芯片,芯片设计包含两个串联的流动聚焦交叉结,通过 CleWin 软件完成微通道图案设计,核心通道宽度为 200μm,收缩区宽度 50μm,通道深度 130μm,确保液滴生成与凝胶化反应的有序进行。在芯片制备过程中,SU-8 光刻胶模具经硅烷化处理后,将 PDMS 基料与固化剂按 10:1 比例混合、脱气,倒入模具后在 80℃烘箱中固化 3 小时,经活检打孔制备进出口后,通过氧气等离子处理实现 PDMS 与玻璃基片的键合。为保证油相连续相的流动稳定性,芯片微通道经 Rain-X® 疏水修饰,显著降低了液滴粘附风险。
该制备流程充分整合了 PDMS 芯片加工平台的核心技术,包括光刻胶模具制备、PDMS 浇筑、等离子键合、疏水修饰等关键步骤,其加工精度与稳定性得益于 MEMS 加工技术的成熟应用,为后续水凝胶微球的规模化制备奠定了设备基础。
2) 外部凝胶化技术原理与实施
外部凝胶化技术的核心是通过乳化钙离子形成交联相,实现海藻酸钠液滴的逐步凝胶化。研究选用氯化钙作为交联剂,与矿物油、Span®80 表面活性剂混合后,经超声均质机制备水包油乳液,其中 Span®80 质量分数为 1.25%,油水体积比固定为 1:5,确保乳液的稳定性与钙离子的均匀分布。
在微流控芯片运行过程中,分散相(海藻酸钠溶液或海藻酸钠 – 小球藻混合液)从 inlet1 以 400μL/hr 流速注入,矿物油从 inlet2 以 1000μL/hr 流速注入,在第一个交叉结形成均匀液滴;随后 inlet3 切换为氯化钙乳液,在第二个交叉结实现液滴与钙离子的接触,通过钙离子向液滴内部的梯度扩散引发交联反应,形成海藻酸钙水凝胶微球。收集后的微球经离心分离、氯化钙溶液冲洗,去除残留乳液后用于后续培养实验。该工艺有效避免了内部凝胶化中盐颗粒沉淀导致的通道堵塞问题,体现了外部凝胶化技术在微流控芯片应用中的独特优势。
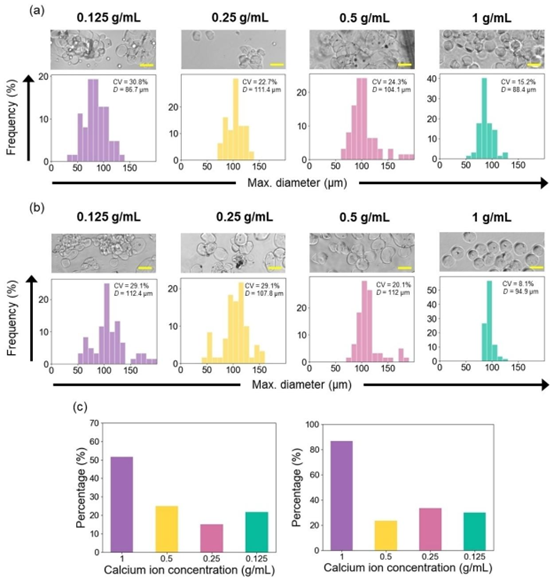
图2. 不同钙离子浓度交联的海藻酸钙水凝胶微球的几何分析(含微藻包封和不含微藻包封):(a)空白微球和(b)包封微藻的微球的显微图像及微球尺寸分布;(c)高球形(球形度\(5<0.05\))的空白微球(左)和包封微藻的微球(右)的比例。值D表示最大直径的平均值。比例尺为100μm。
3) 微藻预处理与封装优化
小球藻(Chlorella vulgaris CS-41)在 BG-11 培养基中预培养 6 天,经离心(4500rpm,5 分钟)收集指数生长期细胞,重悬于超纯水中备用。为实现单细朐高效封装,基于泊松分布模型计算最优细胞浓度,结合微流控芯片液滴体积(直径 100-120μm),确定预封装溶液中细胞浓度为 1.1×10⁶-3.7×10⁶ cells/mL,通过细胞计数与梯度稀释确保封装效率。

图3. 在5天时间内,海藻酸钙水凝胶珠(钙离子浓度1 g/mL)中微藻细胞的生长情况,通过显微镜明场图像和荧光图像观察。在荧光图像中,含有包埋微藻细胞的水凝胶珠边界用白色虚线圆圈标记。比例尺为100 μm。
封装过程中,海藻酸钠溶液与微藻悬液按 1:1 体积比混合,形成 2%(w/w)的分散相,该浓度既保证了液滴的稳定性,又为微藻生长提供了充足空间。通过优化分散相粘度与流动速率,进一步提升了水凝胶微球的尺寸均一性,为后续培养实验的重复性提供了保障。
3. 性能表征与培养效果分析
1) 水凝胶微球的几何性能优化
研究系统考察了钙离子浓度(0.125g/mL、0.25g/mL、0.5g/mL、1g/mL)对微球尺寸均一性与球形度的影响。结果表明,随着钙离子浓度升高,微球的变异系数(CV)逐渐降低,当浓度达到 1g/mL 时,空白微球与封装微球的 CV 值分别降至 7% 与 15%,且高度球形(球形度 < 0.05)的微球占比超过 80%,显著优于低浓度组。
值得注意的是,封装微球因分散相粘度增加,在高钙离子浓度下表现出更优的结构稳定性,这一现象印证了分散相粘度与交联程度对微球几何性能的协同作用。该结果为微流控芯片定制化制备功能性微球提供了关键参数参考,也为器官芯片加工中载体材料的性能优化提供了新思路。
2) 微藻培养效果与稳定性评估
在 5 天培养周期内,采用 LED 光源(光暗周期 12:12,PPFD=57μmol/m²・s)、25℃恒温条件下进行培养,通过明场与荧光显微镜观察微藻生长状态。结果显示,封装效率高达 99.65%,微藻在水凝胶微球内部实现稳定增殖:第 1 天以单细胞分布为主,第 3 天形成多细胞聚集体,第 5 天出现明显细胞簇,表明微流控封装并未影响微藻的代谢活性。
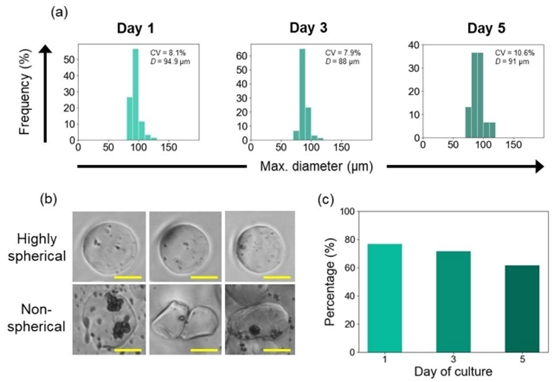
图4. 海藻酸钙水凝胶微球在5天培养期内的几何变化:(a)培养期间的微球尺寸分布;(b)典型高球形和非球形微球的显微镜图像;(c)高球形水凝胶微球的比例(球形度S \(5<0.05\))。最大值D表示最大直径的平均值。比例尺为50μm。
几何稳定性分析表明,微球在培养前 3 天保持良好的尺寸均一性(CV<10%),第 5 天出现轻微形状畸变与尺寸波动,同时观察到少量细胞泄漏,这主要归因于水凝胶在 aqueous 介质中的溶胀及 BG-11 培养基中单价离子与钙离子的交换作用。尽管如此,微球在整个培养周期内未发生明显破裂,证明其具备良好的结构韧性,为长期培养应用提供了可能。
3) 技术优势与传统方法对比
与传统内部凝胶化技术相比,该技术具有三大核心优势:一是通过外部凝胶化避免了通道堵塞,提升了微流控芯片的运行稳定性,降低了 MEMS 加工后芯片的维护成本;二是高钙离子浓度下制备的微球尺寸均一性更高,为培养条件的精准调控提供了保障;三是封装效率接近 100%,显著降低了细胞损耗,符合规模化培养的经济性要求。此外,该工艺采用的 PDMS 芯片、氯化钙、海藻酸钠等材料均具备低成本、易获取的特点,为技术的产业化转化奠定了基础。
4. 应用前景与行业价值
1) 微藻培养领域的直接应用
该技术为微藻生物质的高效生产提供了新方案,在生物燃料、食品补充剂、碳封存等领域具有广阔应用前景。通过微流控芯片的精准调控,可实现微藻生长条件的个性化优化,提升蛋白质、脂质等目标产物的产量,而水凝胶微球的保护作用可降低外界环境对微藻的影响,进一步提升培养效率。未来可结合微流控芯片的集成化设计,实现培养、分离、检测的一体化,推动微藻产业的智能化升级。
2) 在类器官与细胞培养芯片中的拓展
该技术的核心原理可迁移至类器官芯片、3D 细胞培养芯片等高端生物芯片的研发中。通过调整水凝胶材料成分(如添加胶原蛋白、明胶等),可模拟体内细胞外基质环境,为干细胞、肿瘤细胞等的培养提供更适宜的载体;而微流控芯片的微型化特性可实现多器官芯片的并联培养,为药物筛选、疾病模型构建提供更贴近生理真实的平台。此外,该技术中采用的外部凝胶化与 PDMS 芯片加工工艺,可直接应用于器官芯片加工设备的优化,提升产品的稳定性与重复性。
3) 推动微流控行业的技术创新
该研究进一步丰富了微流控芯片的应用场景,为微流控代工、MEMS 代工加工等行业提供了新的业务方向。随着技术的成熟,可开发针对微生物培养的专用微流控芯片,结合数字 PCR、荧光检测等技术,构建一体化分析平台;同时,该技术中积累的微通道设计、表面修饰、液滴操控等经验,可为微纳加工行业提供参考,推动微流控芯片在生物医学领域的规模化应用。
5. 结语
该研究通过外部凝胶化技术与液滴基微流控芯片的创新结合,成功实现了小球藻的高效封装与稳定培养,不仅解决了传统凝胶化技术中通道堵塞、均一性差等问题,更构建了一套兼具科学性与实用性的微藻培养新体系。在技术层面,该研究优化了 PDMS 微流控芯片的设计与制备工艺,明确了钙离子浓度对水凝胶微球性能的调控规律,为相关产品的研发提供了关键数据支撑;在应用层面,该技术既适用于微藻培养等规模化场景,又可拓展至类器官芯片、3D 细胞培养等高端领域,展现出极强的技术兼容性与市场潜力。
未来,随着微纳加工技术的持续进步与微流控芯片的集成化发展,该技术有望实现培养周期延长、多细胞共培养、在线检测等功能升级,进一步推动微流控技术在生物培养领域的产业化应用。同时,该研究的创新思路也为微流控行业的技术研发提供了新方向,助力我国在微流控芯片定制、器官芯片加工等高端领域占据国际领先地位。
参考文献:doi.org/10.1002/cnma.202400549
Dxfluidics Products
Ordering Methods



© 2026. All Rights Reserved. 苏ICP备2022036544号-1












