1. 引言:中医药研究的痛点与技术革新需求
中医药作为传统医学体系,拥有数千年的临床实践积累,但现代研究中仍面临诸多挑战:天然药物成分复杂且微量成分生物活性显著,导致多成分 – 多靶点的作用机制难以解析;传统 2D 细胞培养模型缺乏细胞异质性与微环境交互,动物模型存在物种差异,均无法精准模拟人体生理病理状态,制约了中药活性成分筛选与安全性评价效率。在此背景下,类器官(Organoid)与器官芯片(Organ-on-a-chip, OOAC)技术应运而生,二者作为 2D 培养与动物模型的重要补充,能更真实复现人体器官结构与功能,为中医药研究提供了全新技术平台。其中,以 PDMS (polydimethylsiloxane)为核心材料的微流控芯片技术,结合 MEMS 加工、微纳加工平台等工艺,成为 OOAC 实现精准微环境调控的关键支撑,为破解中医药研究难题奠定了技术基础。
2. 类器官技术:中医药 efficacy 与毒性评价的新载体
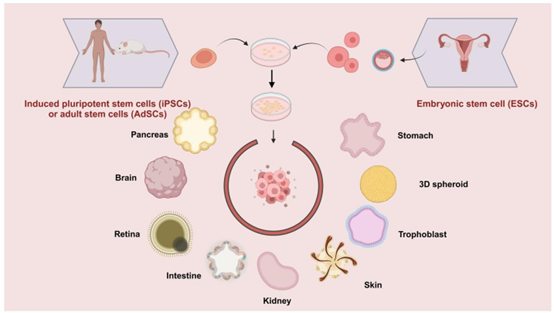
类器官可由人或动物的胚胎干细胞(ESCs)、多能干细胞(iPSCs)或成体干细胞(AdSCs)诱导产生。特定靶类器官模型的生成需要添加相应的诱导因子。
类器官是通过干细胞(诱导多能干细胞 iPSCs、胚胎干细胞 ESCs 或成体干细胞 AdSCs)在 3D 环境中自组装形成的微型器官结构,具备与体内器官相似的组织形态和生理功能,已广泛应用于中医药的 efficacy 验证、毒性评估与机制研究,尤其在特定器官相关疾病的中药干预中展现出独特优势。
1) 肠道类器官:解析中药调节肠道稳态的机制
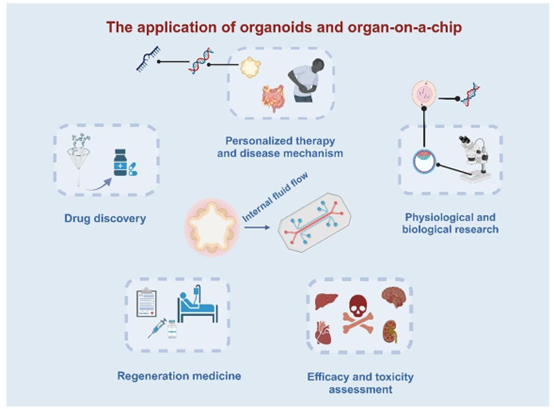
可以模拟体内流体流动机制以及基础生理学研究。类器官还可用于再生医学。与类器官相比,器官芯片(OOAC)技术(类器官与器官芯片)可用于药物发现、疗效和毒性评估、个性化治疗、疾病
肠道是中药吸收与发挥药效的重要场所,肠道类器官(IOs)能精准复现肠道上皮的隐窝 – 绒毛结构,成为研究中药干预肠道疾病的理想模型。文献中提及,甘草次酸(GA,甘草活性成分)可通过上调肠道类器官中 HuR 蛋白表达,促进肠道上皮生长与修复;葛根芩连汤(GQD)则能抑制铁死亡通路,改善肠道屏障功能障碍,这些研究均基于 3D 细胞培养体系实现。在技术层面,肠道类器官的长期培养常依赖微流控芯片提供的动态营养供给,通过 PDMS 芯片构建的微通道模拟肠道蠕动,结合醛基化修饰或 PEG 修饰的载玻片优化细胞黏附环境,进一步提升类器官的生理真实性,为中药复方(如参苓白术散)调节肠道 pyroptosis 的机制研究提供了稳定模型。
2) 肝脏类器官:攻克中药肝毒性评价难题
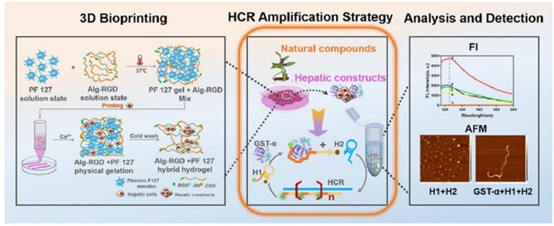
经参考文献[61]许可。2023年Acta Materialia Inc.版权所有。由爱思唯尔有限公司出版,用于监测早期肝毒性生物标志物,即由3D肝脏构建体分泌的谷胱甘肽-S-转移酶-α(GST-α)。转载自天然化合物相关内容。该系统集成了基于杂交链式反应(HCR)扩增策略的高性能荧光传感器,旨在采用杂交链式反应(HCR)扩增策略的3D肝脏传感器平台,用于直观评估肝毒性
肝脏是中药代谢的核心器官,肝类器官因具备与体内肝细胞相似的代谢酶活性,成为评价中药肝毒性的关键工具。研究人员通过人肝细胞系与 HepaRG 细胞构建 3D 肝类器官,成功区分了二苯乙烯苷(trans-SG)与其顺式异构体(cis-SG)的肝毒性差异,发现 cis-SG 通过损伤线粒体加剧肝损伤 —— 这一结果与动物实验高度一致,却无法通过传统 2D 培养获得。此外,基于热响应性水凝胶构建的肝类器官平台,结合 glutathione-S-transferase-alpha(GST-α)荧光传感器,可实时监测大黄素、雷公藤甲素等中药成分的早期肝毒性,而 PDMS 芯片的良好透气性与生物相容性,进一步支撑了肝类器官的长期稳定培养,为中药肝毒性的高通量筛选提供了可能。
3) 肿瘤类器官:中药抗肿瘤活性成分的筛选利器
肿瘤类器官保留了原发肿瘤的异质性与治疗响应特性,为中药抗肿瘤成分筛选提供了精准模型。例如,从臭椿中提取的鸦胆子苦素(AIL)可通过下调 p23 蛋白抑制碱基切除修复,进而抑制胃癌类器官的球化能力;片仔癀中的人参皂苷 F2 与 Re 则能显著抑制结直肠癌类器官生长。在技术实现上,肿瘤类器官的培养常结合微流控芯片技术:通过光刻胶模具制备 PDMS 微流控芯片,利用微通道精准控制中药成分浓度梯度,结合微流控芯片检测技术实时监测肿瘤细胞凋亡,而 MEMS 加工工艺制作的微纳结构则能模拟肿瘤微环境中的物理屏障,进一步提升筛选结果的临床相关性。
3. OOAC 与微流控技术融合:破解中医药多靶点研究难题
器官芯片(OOAC)以微流控芯片为核心载体,通过集成活体细胞与微环境调控单元,精准复现器官的生理功能与病理过程。其制作过程高度依赖 PDMS 加工设备、MEMS 加工技术与微纳加工平台:采用软光刻技术,以光刻胶模具为基础制备 PDMS 芯片,通过 PDMS 键合机确保微通道密封,结合深硅刻蚀、电子束光刻等工艺构建复杂微结构,同时利用表面修饰技术(如羧基玻片、环氧基修饰)优化芯片表面性能,提升细胞相容性 —— 这些技术环节共同支撑了 OOAC 在中医药研究中的应用。
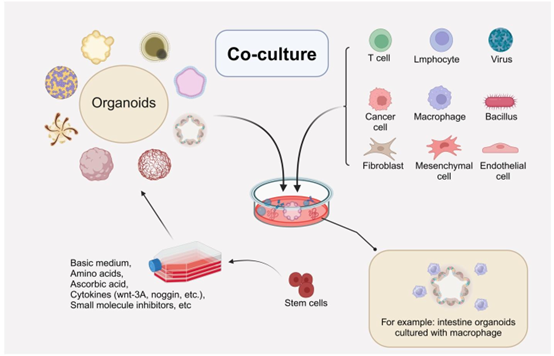
为了研究微环境中与其他相关细胞的相互作用,类器官可以与各种免疫细胞、癌细胞、微生物(细菌、真菌、病毒)等共培养。例如,与巨噬细胞的共培养系统为肠道类器官提供了类似于体内的肠道免疫微环境。
1) 疾病模拟:复现中药干预的病理场景
OOAC 能精准模拟人体疾病状态,为中药疗效验证提供可控环境。例如,肺芯片通过 PDMS 微通道构建肺泡 – 毛细血管单元,模拟肺泡气液界面与机械张力,可用于研究中药成分(如木犀草素)对 LPS 诱导的肺损伤的修复作用;脑芯片则能复现血脑屏障结构,助力人参多糖等中药成分穿越血脑屏障、抑制 Aβ 聚集的机制研究。此外,肠道芯片结合肠道上皮细胞与免疫细胞共培养,可模拟溃疡性结肠炎的炎症微环境,为肠宁汤等中药复方调节肠道免疫、降低 ROS 水平的研究提供了动态模型。
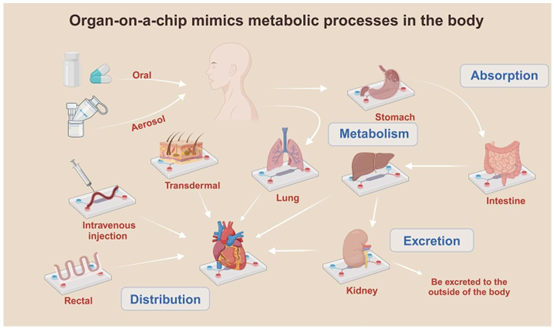
各种器官芯片连接应用能够在体外相对完整地模拟体内的药物递送代谢系统。在这一框架中,涉及多个器官,包括肺、肝脏、血管、肠道、心脏、肾脏、胃和透皮组织。
2) 毒性评价:提升中药安全性评估精度
OOAC 的动态培养特性使其成为中药毒性评价的理想工具。研究人员利用肾脏芯片(由人胚胎肾细胞构建)评价山奈酚的肾毒性,发现 30μM 浓度下无细胞损伤,而传统 2D 模型无法捕捉这种浓度依赖性差异;心脏芯片则通过监测心肌细胞电生理活动,评估了氯化两面针碱、氯化白屈菜红碱等中药成分的心脏安全性。在技术层面,微流控芯片的精准流体控制能力(如剪切力调节)模拟了体内血液流动,结合微流控芯片分析仪实时检测细胞代谢指标,大幅提升了中药毒性评价的灵敏度与准确性。
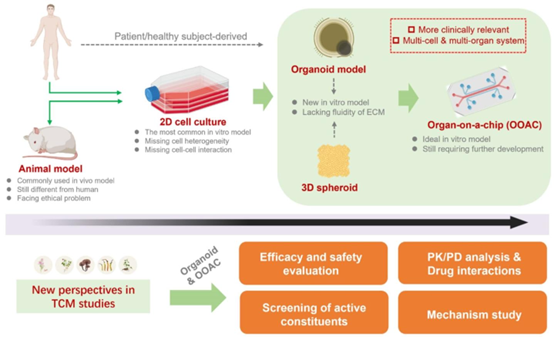
老年模型的活性成分筛选及机制研究。通常,包含细胞异质性、细胞间通讯或器官间相互作用的类器官和器官芯片(OOAC),其筛选和评估方法在不断发展。新兴的类器官和器官芯片技术有效弥补了部分不足(图6 从单层细胞培养、动物模型到类器官技术和器官芯片模型),这些药物相关技术可能与临床更具相关性,这为中医药在疗效/安全性评价、药代动力学-药效动力学分析、药物相互作用等领域的研究提供了便利。
3) 多器官芯片(MOC):解析中药的体内代谢过程
多器官芯片通过微流控通道连接肺、肝、肾等单个器官芯片,构建 “吸收 – 分布 – 代谢 – 排泄”(ADME)系统,为中药多成分代谢研究提供了全新方案。例如,将肠道芯片与肝脏芯片串联,可模拟中药成分经肠道吸收后在肝脏的代谢转化,追踪活性代谢产物对其他器官的影响;而 PDMS 芯片的低吸附特性则能减少中药成分的非特异性损失,确保代谢数据的可靠性。目前,MOC 已用于研究葛根芩连汤中黄芩苷在肠道 – 肝脏中的代谢路径,为中药复方的药效物质基础解析提供了关键数据。
4. 当前挑战与未来展望
尽管类器官与 OOAC 技术在中医药研究中取得显著进展,仍存在亟待突破的瓶颈:类器官缺乏完整血管网络,导致内部细胞营养供应不足,可通过微纳加工平台构建血管化微结构,结合 PDMS 对准平台实现血管与器官类器官的精准对接;OOAC 的器官功能模拟仍不完整,需进一步优化 MEMS 加工工艺,提升微通道精度与流体控制能力,同时利用长效亲水处理技术改善芯片表面生物相容性,延长细胞存活时间。
未来,随着技术的迭代,二者将在中医药研究中实现更深度的应用:一方面,定制化微流控芯片将结合患者来源的类器官,实现中药个性化疗效预测,例如针对肝癌患者构建个性化肝类器官 – 芯片系统,筛选最优中药方案;另一方面,类器官与 OOAC 将与多组学技术结合,解析中药多成分 – 多靶点的作用网络,例如通过脑类器官 – 芯片平台,结合转录组学研究人参皂苷对阿尔茨海默病的干预机制。此外,PDMS 微流控芯片的量产工艺优化(如利用微流控芯片工厂实现规模化生产)、微流控芯片价格的降低,也将推动这些技术在中医药企业中的普及应用。
类器官与器官芯片技术的出现,为中医药现代化研究提供了 “从实验室到临床” 的精准桥梁。依托 PDMS 加工、MEMS 微纳加工、表面修饰等核心技术,二者不仅解决了传统模型的局限,更能精准捕捉中药多成分的复杂作用机制,为中药活性成分筛选、安全性评价与复方机制解析提供了全新路径。未来,随着技术的不断成熟与融合,类器官与器官芯片将成为推动中医药走向国际化、精准化的核心技术支撑,助力中医药在现代医学体系中发挥更大价值。
参考文献:https://doi.org/10.1186/s13020-025-01071-8
Dxfluidics Products
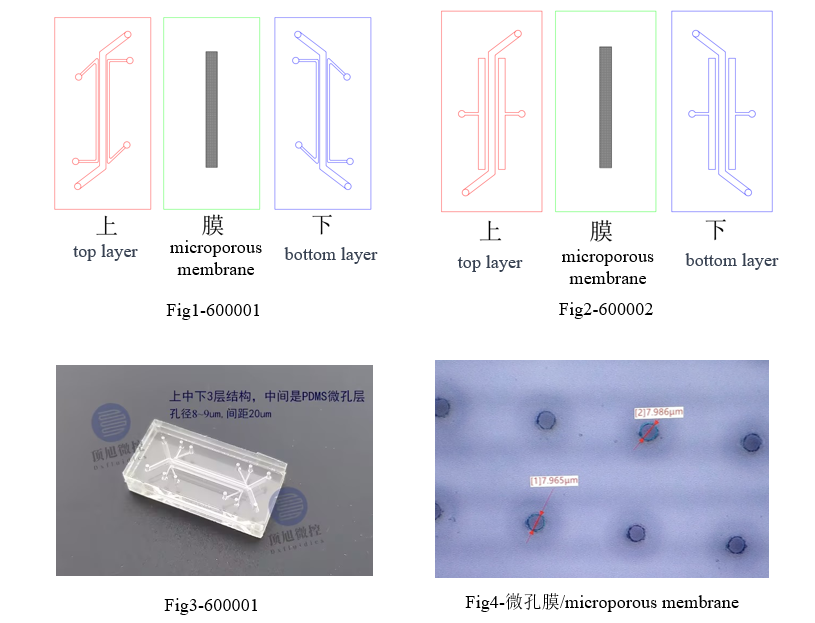
| Product Code | Outline (mm) | Channel | Microporous membrane | Material | Price (CNY) | |||
| Height (mm) | Width (mm) | Space (mm) | Thickness (um) | Hole diameter (um) | ||||
| 600001 | 30*15 | 0.5 | 1 | 0.2 | 25 | 8 | PDMS | 800 |
| 600002 | 30*15 | 0.5 | 1 | 0.5 | 25 | 8 | PDMS | 800 |
Ordering Methods



© 2026. All Rights Reserved. 苏ICP备2022036544号-1













