参考文献:https://doi.org/10.1093/procel/pwaf058
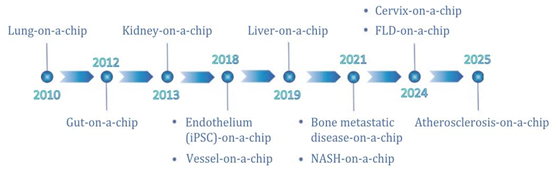
器官芯片发展时间线。
1. 政策驱动与生物医药技术变革背景
2025 年成为生物医药研究范式转型的关键节点 —— 美国 FDA 于 4 月 10 日发布指导方针,明确逐步淘汰动物实验,转而认可类器官与器官芯片(organ-on-a-chip)系统的实验数据;仅 19 天后,美国国立卫生研究院(NIH)成立 “研究创新、验证与应用办公室(ORIVA)”,聚焦以人类为中心的器官芯片技术研发,标志着全球生物医药研究正式迈入 “人体相关性” 监管新时代。这一变革直指传统研究模型的核心痛点:传统 2D/3D 细胞培养缺乏血管系统与动态力学信号,动物模型存在种间差异与实验周期长的问题,导致 90% 通过临床前评估的药物在人体试验中失败。而器官芯片与类器官技术的协同,正通过微流控系统、仿生材料与干细胞技术的整合,解决这些瓶颈。
在技术落地层面,这一政策推动了微流控芯片、PDMS 芯片及配套加工设备的需求爆发。例如,PDMS(聚二甲基硅氧烷)因兼具柔性、光学透明性与生物相容性,成为器官芯片核心制备材料,其加工依赖 PDMS 等离子键合机、PDMS 对准平台、PDMS 浇筑器等专用设备;同时,3D 细胞培养芯片、类器官微流控芯片等细分产品,也因能精准模拟人体器官微环境,成为药物筛选与疾病建模的核心工具。
2. 器官芯片与类器官的技术融合:从 “单功能” 到 “系统级” 突破
器官芯片与类器官技术的协同,本质是 “生物自组织” 与 “工程精准控制” 的结合。类器官作为 “体外微型器官”,由多能干细胞或成体干细胞自组织形成,能复现体内器官的细胞组成与空间结构,如肠道类器官、肝类器官等,但其培养缺乏可控微环境;而器官芯片通过微流控技术,在厘米级芯片上构建动态生理微环境,可精准调控流体剪切力、周期性拉伸等力学信号,以及氧气、细胞因子等生化梯度 —— 两者融合形成的 “类器官芯片(organoid-on-a-chip)”,既保留类器官的细胞异质性,又具备器官芯片的动态调控能力,成为新一代体外模型的核心形态。
从材料与加工来看,这一融合依赖多维度技术支撑。芯片基底除 PDMS 外,还包括 COC(环烯烃共聚物)、COP(环烯烃聚合物)及玻璃芯片:COC/COP 因低小分子吸附特性,适用于药物代谢研究;玻璃芯片则凭借稳定性,成为微流控芯片设计与加工的优选基底,其定制需依赖玻璃芯片加工设备与光刻胶模具(如 SU8 光刻胶模具)。在表面功能化环节,醛基玻片、羧基玻片、PEG 修饰载玻片等表面修饰技术,可优化细胞黏附与信号传导,进一步提升芯片模型的生理相关性。
3. 单器官芯片技术突破:精准复现器官功能与病理过程
单器官芯片已实现多系统覆盖,其核心是通过 “细胞 – 材料 – 力学” 的协同设计,复现特定器官的功能单元,成为疾病建模与药物毒性评估的关键工具。
1) 消化系统芯片:聚焦肠道 – 肝脏轴核心功能
肠道芯片通常采用双层微流控结构,上层通道接种 Caco-2 细胞或患者来源肠道类器官,下层通道培养人肠微血管内皮细胞(HIMECs),中间以 PDMS 多孔膜分隔;通过 30-60μL/h 的流体灌注与 10% 应变、0.15Hz 的周期性拉伸,模拟肠道蠕动与营养吸收。此类芯片可用于研究炎症性肠病(IBD)、肠道菌群互作,配套的肠道芯片加工设备还能实现高 – throughput 筛选。
肝脏芯片则以原代人肝细胞(PHHs)、肝窦内皮细胞(LSECs)、库普弗细胞的共培养为核心,结合微流控系统模拟肝血窦的剪切力环境(0.01-0.5dyn/cm²)。Emulate 公司的肝脏芯片已通过 FDA 验证,能检测出 87% 通过动物实验却导致人类致命肝毒性的药物,其精准性依赖 PDMS 芯片键合对准平台确保的流体均匀性,以及微流控肝脏芯片加工设备实现的细胞空间分布控制。
2) 呼吸系统与神经系统芯片:突破屏障功能模拟
肺芯片以 “气 – 液界面(ALI)” 为设计核心,上层通道接种原代人肺泡上皮细胞(含 I 型、II 型肺泡细胞)并通入气体,下层通道培养肺微血管内皮细胞,通过 5% 应变、0.2Hz 的拉伸模拟呼吸运动。该模型已成功用于流感病毒、SARS-CoV-2 感染研究,其加工需依赖微流控光刻技术与紫外掩膜光刻机,确保 PDMS 芯片通道的微米级精度。
脑芯片则聚焦血脑屏障(BBB)模拟,采用 iPSC 诱导的脑微血管内皮样细胞(iBMECs)、星形胶质细胞与神经元共培养,结合 0.01dyn/cm² 的生理剪切力,复现 BBB 的选择透过性。血脑屏障芯片可用于评估药物的脑渗透效率,其制备需搭配微纳加工平台与电子束光刻技术,实现芯片通道与传感器的精准集成。
4. 多器官芯片系统级创新:模拟人体代谢网络与疾病传播
多器官芯片通过微流控通道串联不同单器官模型,复现体内器官间的代谢耦合与信号传导,解决传统单器官模型无法模拟 “系统级毒性” 的痛点。例如,肠 – 肝芯片通过流体循环连接肠道芯片与肝脏芯片,可模拟药物的 “首过效应”—— 药物经肠道吸收后进入肝脏代谢,其代谢产物的毒性评估需依赖 MEMS 微流控系统实现的精准流体控制,以及 MEMS 代工加工提供的微纳通道结构。
在疾病建模领域,“转移芯片(metastasis-on-a-chip)” 通过串联肠道芯片(含肿瘤灶)与肝脏芯片,实时追踪荧光标记肿瘤细胞的迁移过程,其加工需结合 MEMS 微纳加工技术与 3D 细胞培养芯片设计;而糖尿病模型则通过共培养胰岛微组织与肝脏球状体,复现胰岛素 – 葡萄糖反馈调节回路,配套的 3D 细胞培养芯片加工设备可确保细胞球状体的均匀性。
5. 核心技术支撑:从材料加工到产业适配
器官芯片的规模化应用,依赖材料、加工、检测全链条技术的协同成熟。在加工环节,MEMS 加工技术(如微纳加工平台、电子束光刻加工)是芯片精细化制造的核心,MEMS 代工公司可提供从设计到流片的全流程服务;光刻机(如 UV-KUB3、接触式光刻机)则用于光刻胶模具制备,其中桌面式光刻机因成本可控,成为科研机构与中小企业的优选设备。
在材料与配件领域,PDMS 芯片的加工需 PDMS 打孔器、PDMS 烘箱、PDMS 热板等专用设备,确保芯片的键合强度与通道密封性;表面修饰环节,环氧官能载玻片、氨基修饰磁珠等产品,可提升细胞与芯片界面的生物相容性;而微流控芯片夹具、微流控分配器芯片等配件,则优化了芯片的操作便捷性与检测稳定性。
6. 挑战与未来发展方向
当前器官芯片技术仍面临三大核心挑战:一是标准化不足,不同实验室的芯片设计、细胞来源差异导致数据重复性低,需建立统一的微流控芯片加工与检测标准;二是成本较高,PDMS 芯片加工设备、MEMS 微纳加工的高投入限制规模化应用,未来需通过模块化设计与量产降低成本;三是长期稳定性欠缺,多数芯片模型仅能维持 1-2 周功能,需结合 ECM 水凝胶与动态 perfusion 系统提升长期培养能力。
未来,技术突破将聚焦三大方向:其一,AI 与芯片的深度整合,通过微流控 AI 系统实现细胞行为的实时分析与参数自适应调节;其二,3D 生物打印技术的应用,实现器官芯片的快速定制与复杂结构构建;其三,个性化芯片开发,利用患者 iPSC 诱导的类器官与 PDMS 芯片结合,为罕见病治疗与精准用药提供定制化模型。
器官芯片与类器官技术的协同,正推动生物医药研究从 “动物替代” 向 “人体生理复现” 跨越。随着微流控芯片加工技术的成熟、MEMS 代工服务的普及,以及 PDMS 芯片、3D 细胞培养芯片等产品的产业化,这一技术将在疾病建模、药物研发、精准医疗领域发挥核心作用,成为未来生物医药产业的核心基础设施。
Dxfluidics Products
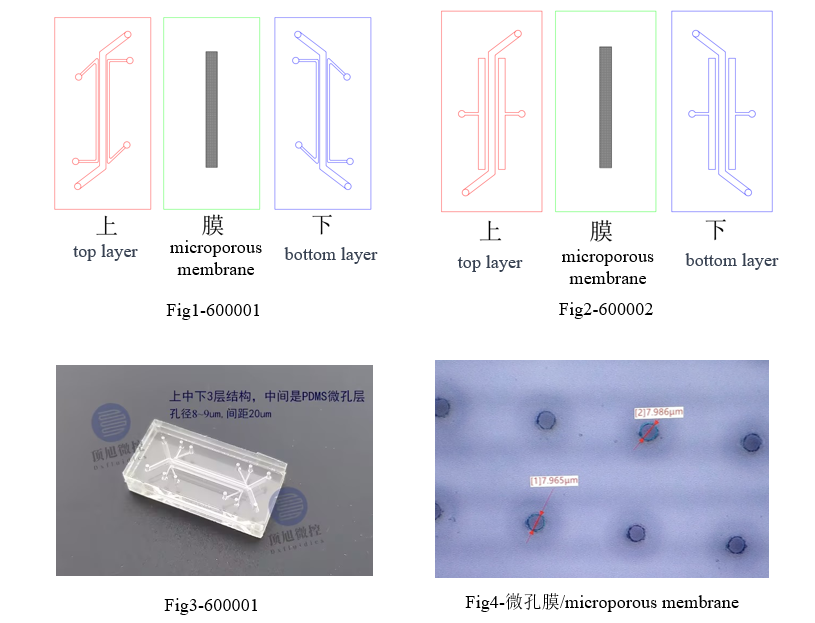
| Product Code | Outline (mm) | Channel | Microporous membrane | Material | Price (CNY) | |||
| Height (mm) | Width (mm) | Space (mm) | Thickness (um) | Hole diameter (um) | ||||
| 600001 | 30*15 | 0.5 | 1 | 0.2 | 25 | 8 | PDMS | 800 |
| 600002 | 30*15 | 0.5 | 1 | 0.5 | 25 | 8 | PDMS | 800 |
Ordering Methods



© 2026. All Rights Reserved. 苏ICP备2022036544号-1













