牙周病宿主 – 微生物相互作用是牙周病发病的核心机制,全球超 10 亿人受牙周病影响,该病不仅破坏牙齿支持组织,还与糖尿病、心血管疾病等系统性疾病密切相关。解析这一相互作用的失衡机制,是开发有效治疗策略的关键,但传统研究依赖的 2D 单层细胞培养与动物模型存在显著局限 ——2D 培养缺乏牙周组织 3D 结构与细胞异质性,动物模型生理差异大、转化效率低,因此推动了 3D 培养与微流控器官芯片技术的发展。
1. 牙周病研究背景与传统模型的局限性
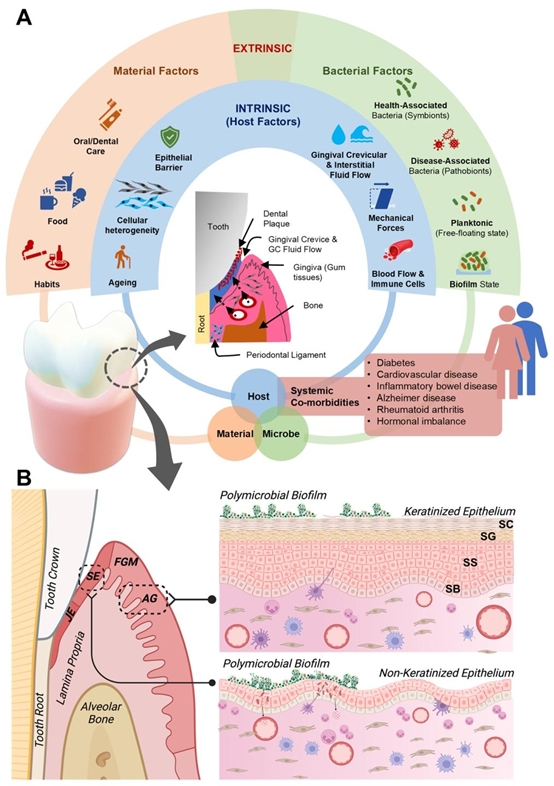
牙周微环境。(A)牙周组织微环境复杂,由环绕牙齿的牙龈软组织构成,并形成一个被称为龈沟的V形沟。该空间内存在牙周微生物组,其与宿主要么存在共生关系,要么存在生态失调关系。被称为龈沟液的宿主结缔组织液从该空间流出,浸润龈沟并为宿主组织提供保护。牙周健康与疾病受内在(宿主)因素和外在因素的影响。内在因素包括宿主组织屏障特性、细胞异质性在驱动免疫反应中的影响、宿主衰老、调节宿主对有害刺激反应的先天和适应性免疫系统,以及各种全身性合并症。外在因素包括口腔微生物组及其成分、多样性和状态,以及饮食和习惯的影响,这些因素可直接或间接影响宿主的保护反应。(B)示意图显示牙龈的形态学和组织学区域,包括附着龈(AG)、游离龈缘(FGM)、沟内上皮(SE)和结合上皮(JE)。附着龈和沟内上皮的分解图显示了上皮细胞的分层结构,即基底层(SB)、棘层(SS)、颗粒层(SG)和角质层(SC)。上皮下方是牙龈结缔组织(固有层),其中牙龈成纤维细胞是最丰富的细胞,负责产生细胞外基质和胶原纤维。炎症细胞(包括中性粒细胞、淋巴细胞和巨噬细胞)在免疫防御、组织重塑以及应对牙周生态失调方面发挥着关键作用。内皮细胞排列在血管内,促进营养交换和免疫细胞募集。B部分由https://Biorendor.com制作。
牙周病作为一种慢性炎症性疾病,不仅影响牙齿支持组织,还与糖尿病、心血管疾病等系统性疾病密切相关,全球超 10 亿人受其影响。解析牙周微生物群与宿主炎症反应的失衡机制,是开发有效治疗策略的核心。传统研究依赖 2D 单层细胞培养与动物模型,但存在显著局限:2D 培养仅能模拟单一细胞环境,缺乏牙周组织固有的 3D 结构、细胞异质性及细胞外基质(ECM)相互作用,无法复现微生物与宿主的多因素动态交互;动物模型虽能模拟疾病进展,但生理差异(如啮齿类动物的持续生长门牙、口腔菌群组成差异)、伦理争议及高成本,导致研究结果向人类临床转化的效率较低。
为突破这些局限, tissue engineering 与微流控技术的融合推动了新一代体外模型的发展,从 3D 器官型培养到微流控器官芯片(OoC)系统,逐步实现对牙周微环境的精准复刻,为研究牙周宿主 – 微生物相互作用提供了更贴近生理的平台。
2. 3D 器官型培养模型:重构牙周组织微环境
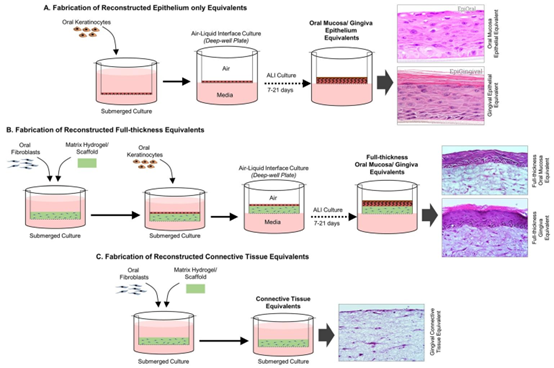
器官型培养物在研究牙周宿主-微生物相互作用中的作用。(A)重建纯上皮等效物的制作:将口腔/牙龈角质形成细胞接种到Transwell中进行浸没培养,然后转移至气-液界面,以促进上皮分层和分化。(B)重建全厚度口腔/牙龈等效物的制作:在Transwell培养装置上浇铸包埋有基质细胞的水凝胶,然后接种角质形成细胞进行浸没培养,并置于气-液界面,以生成分层且完全分化的组织等效物。(C)牙龈结缔组织等效物的制作:浇铸含有基质细胞的水凝胶,然后进行浸没组织培养。
3D 器官型培养通过整合多细胞类型与结构化 ECM,首次实现了牙周组织多层结构的体外模拟,主要包括上皮等效模型、全层牙龈等效模型及结缔组织等效模型三类,为解析微生物与宿主组织的局部交互提供了关键工具。
上皮等效模型通过将口腔角质形成细胞接种于多孔膜或脱细胞胶原基质,经气液界面(ALI)培养诱导细胞分层分化,形成类似牙龈上皮的复层鳞状结构,可模拟上皮屏障对微生物的防御作用。研究显示,该模型能有效评估牙龈卟啉单胞菌等致病菌的侵袭过程,观察到致病菌对上皮紧密连接的破坏及炎症因子(如 IL-8)的分泌变化。全层牙龈等效模型则进一步融入成纤维细胞,通过上皮 – 间质对话调控上皮形态与屏障功能,更精准复现牙龈组织的生理结构 —— 此类模型中,成纤维细胞分泌的胶原纤维为上皮提供力学支撑,同时调控角质形成细胞的增殖与分化,当暴露于多物种生物膜(如具核梭杆菌与中间普氏菌共培养体系)时,能观察到组织层面的炎症反应与 ECM 重塑。
结缔组织等效模型(如基于纤维蛋白的牙龈结缔组织模型)则聚焦于牙周韧带、牙槽骨等支持组织的模拟,可研究微生物及其代谢产物对成纤维细胞、成骨细胞功能的影响。例如,通过该模型发现,具核梭杆菌可诱导牙龈成纤维细胞分泌基质金属蛋白酶(MMP-2、MMP-9),加速 ECM 降解,这与临床牙周组织破坏机制高度一致。此外,3D 器官型培养还支持细胞共培养芯片的构建,实现免疫细胞(如巨噬细胞)与实质细胞的共培养,观察免疫细胞对微生物入侵的极化反应 —— 共生菌可诱导巨噬细胞向抗炎症表型转化,而致病菌则推动其向促炎症表型分化,为解析牙周炎症的启动机制提供了直接证据。
3. 微流控与器官芯片技术:突破静态培养瓶颈
1) 牙周微流控芯片的核心设计与功能
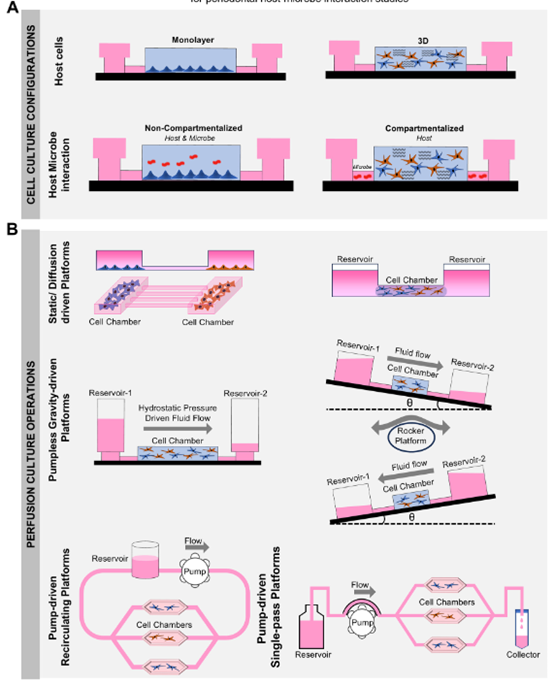
微流控器官芯片系统的设计和流体流动指导原则 图6 用于牙周宿主-微生物相互作用的器官芯片设计和流体控制原则。(A)宿主细胞可在流体装置上以单层或三维基质形式培养。装置设计决定了微生物与宿主细胞的相互作用方式。宿主细胞和微生物组之间的相互作用可以是直接的,也可以通过装置中相互连接的区域实现分区。这种配置紧密再现了牙周空间——在那里,细菌生物膜和牙龈组织彼此紧密接触,但拥有各自的区域和维持生存所必需的独特微环境。(B)培养基灌注是器官芯片装置的独特功能之一,它有助于为宿主和微生物区域主动输送新鲜营养,并持续清除代谢废物。它在间质流诱导的机械转导中也起着关键作用,并通过细胞因子和趋化因子的梯度模拟流体流动诱导的宿主保护反应。这些装置上的流体流动可通过基于静水压的无泵系统进行调节,该系统可通过改变流体储液器中的培养基柱高度,或将装置放置在摇床上以形成梯度来工作。使用外部泵进行主动泵送是驱动流体流动的另一种方法,可将蠕动泵或注射泵连接到装置上,并启动和控制循环或单通流体操作。
牙周微流控芯片多采用 PDMS 材料制备,依托lithography技术与MEMS 加工平台实现微通道、微腔室的精准制造,部分结构需通过阳极键合工艺与玻璃基底结合,确保流体密封性;部分复杂结构还需PDMS 键合对准平台校准,保障微通道与细胞培养区域的精准对接。芯片设计聚焦三大核心功能:
- 动态流体模拟:通过 hydrostatic pressure 驱动或蠕动泵控制,实现 GCF 样流体的持续灌注,模拟生理状态下 GCF 对龈沟内微生物的冲刷作用与营养输送功能。研究显示,动态灌注可促进牙龈成纤维细胞的 ECM 分泌,同时调控微生物生物膜的空间分布 —— 与静态培养相比,动态流体环境下的多物种生物膜更易形成类似体内的分层结构,致病菌(如牙龈卟啉单胞菌)更倾向于聚集在微通道底部,贴近 “龈沟” 区域。
- 氧梯度调控:牙周袋内存在从上皮表面有氧环境到袋底厌氧环境的梯度变化,微流控芯片通过 PDMS 的气体通透性与微通道设计,构建有氧 – 厌氧界面。例如,将宿主细胞(如角质形成细胞)接种于靠近芯片表面的有氧区域,微生物(如厌氧菌)接种于微通道深处的厌氧区域,可复现牙周袋内 “宿主组织 – 厌氧微生物” 的共存模式,观察到氧浓度对微生物代谢及宿主炎症反应的调控作用。
- 机械力模拟:通过芯片结构形变(如 PDMS 膜的周期性拉伸)模拟咀嚼、刷牙等机械刺激,研究机械力对牙周组织屏障功能的影响。实验证实,适度机械力(如 10% 拉伸应变)可增强上皮紧密连接完整性,而过度机械刺激则会增加上皮通透性,促进致病菌入侵 —— 这一发现为临床牙周创伤修复提供了体外依据。
2) 专用牙周器官芯片的应用场景

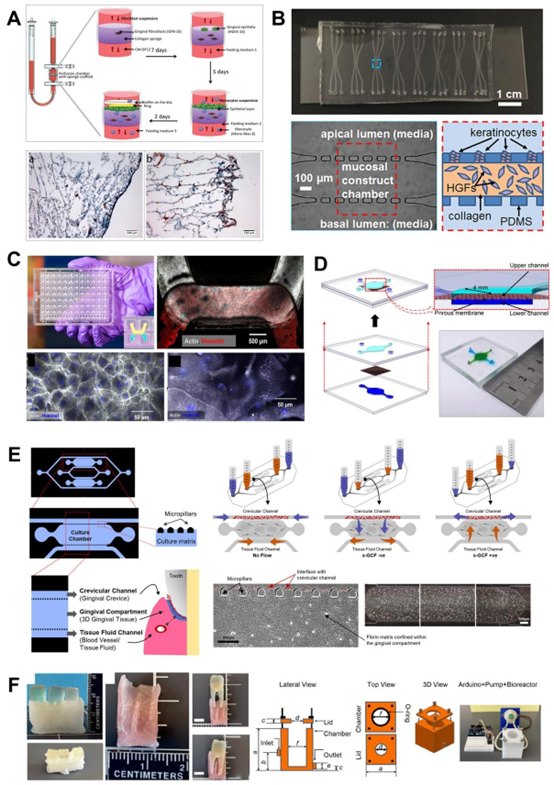
用于牙周细菌生物膜培养的流体装置。口腔生物膜的形成是牙齿和牙周微生物疾病的前兆,人们已开发出流体系统来单独研究这一过程。(A)一种高通量微流体装置,旨在调节各种微生物微环境因素,能够研究口腔生物膜定植菌的空间分布、厚度和活力。同样,(B和C)中的流动池用于在剪切控制条件下培养生物膜,可实时监测pH值、生物膜生长动态和活力。(D)商用生物反应器系统,用于培养牙周多微生物生物膜,通过活力成像了解临床相关剂量抗生素的抗菌效果。图A-D分别改编自参考文献153(经皇家化学会许可,©2016)、参考文献133(经爱思唯尔许可,©2020)、参考文献131(根据CC-BY许可条款)和参考文献155(根据CC-BY许可条款)。
目前已开发的牙周相关器官芯片包括牙龈芯片、牙周韧带芯片、牙齿芯片等,覆盖牙周病研究的关键场景:
- 牙龈沟芯片:采用 “微腔室 – 微通道” 结构,模拟龈沟空间,一侧接种牙龈上皮 – 结缔组织等效体,另一侧通入微生物悬液,通过动态灌注观察微生物入侵路径与宿主炎症反应。研究发现,GCF 样流体的持续流动可降低微生物对上皮的黏附率,同时促进抗炎因子(如 IL-10)的分泌,验证了 GCF 的宿主保护作用。
- 牙周韧带芯片:将牙周韧带细胞与内皮细胞共培养于 fibrin hydrogel 中,构建可灌注血管网络,模拟牙周韧带的营养供应与代谢废物排出。当暴露于脂多糖(LPS) (致病菌代谢产物)时,芯片可实时监测到炎症因子(IL-6、IL-8)的分泌峰值与血管通透性增加,与临床牙周炎早期的血管炎症特征一致。
- 牙齿芯片:通过将牙本质切片嵌入 PDMS 芯片,构建 “牙本质 – 牙髓” 复合模型,评估牙科材料(如钙硅酸盐水泥)的生物相容性与抗菌性能。例如,在芯片中观察到ProRoot 水泥可通过牙本质小管释放钙离子,抑制变形链球菌生物膜形成,同时促进牙髓干细胞的增殖 —— 为牙科材料的体外筛选提供了高效平台。
4. 核心技术支撑:从芯片制备到功能实现
牙周微流控器官芯片的性能依赖于精密的加工技术与材料选择,关键技术环节与配套设备共同保障模型的生理相关性与实验重复性。
D) 具有多孔膜分隔培养室,用于双细胞培养,其中一个通道内有培养基的主动流动,而这些通道可用于接种另一种细胞类型、培养基灌注或生成气液界面。顶端结构装置(C以及柱间距离和培养室高度允许在培养室内加载和容纳包裹着细胞的水凝胶。图8 器官芯片系统设计结构。器官芯片装置的设计特征由预期应用、细胞培养结构和读数决定。其范围可以从(A)基于灌注生物反应器的毫流控装置,(B-D)多室微加工装置,到(E)用于生成器官芯片装置的3D打印模具。(A和E)基于生物反应器的结构允许在灌注室内使用胶原蛋白或丝支架,在那里接种细胞并进行宿主-微生物相互作用研究。用于牙周宿主-微生物相互作用研究的微加工装置采用了侧向和顶端室/通道结构设计。侧向室通道结构(B和E)利用一个柱体(矩形或五边形)将培养室与相邻通道分隔开。气液界面的生成。图A-F分别改编自参考文献23(根据CC-BY许可条款)、参考文献31(经AIP Publishing许可,©2018)、参考文献141(根据CC-BY许可条款)、参考文献28(根据CC-BY许可条款)、参考文献24(经Wiley-VCH GmbH许可,©2022)和参考文献27(经Acta Materialia Inc许可,©2023)。
1) 芯片材料与加工工艺
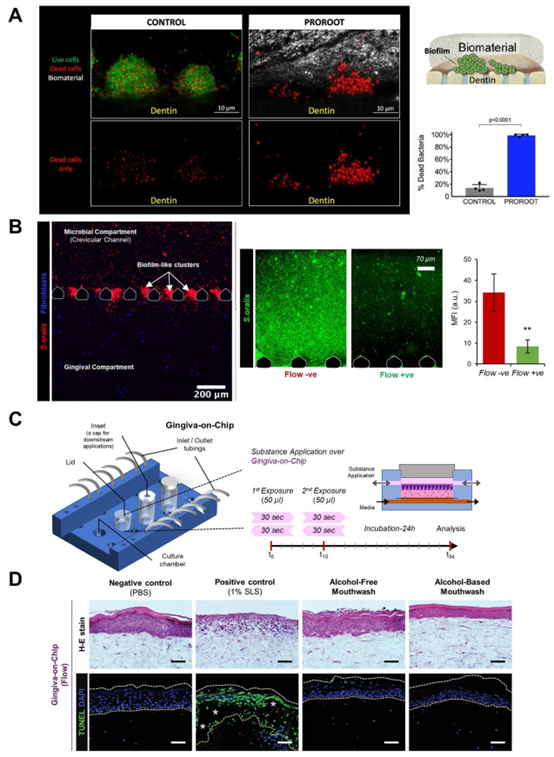
评估器官芯片设备上的宿主-微生物和宿主-材料相互作用。器官芯片(OoC)设备能够对口腔宿主-微生物-材料相互作用进行时空可视化,并有助于理解在微生理条件下牙科生物材料的抗菌性能以及口腔护理产品的生物相容性所产生的影响。这些评估可分别在牙齿芯片平台和牙龈芯片上进行。(A)牙齿芯片平台能够重现牙本质-牙髓复合体,其中人类牙齿切片被嵌入基于聚二甲基硅氧烷(PDMS)的装置中,该装置将宿主细胞和细菌生物膜分隔在不同区域。具有抗菌性能的牙科生物陶瓷被引入装置中,与细菌生物膜接触,其随时间变化的抗菌效果会得到评估。(B)通过牙龈沟芯片,研究了通过分区实现的宿主-微生物长期共存、生物膜形成的可视化,以及龈沟液(GCF)流动对冲洗细菌生物膜的保护作用。(C和D)牙龈芯片支持基于灌注的全厚度牙龈等效物培养,该芯片设计允许从顶端接触上皮表面,从而能够重现漱口的机械作用。暴露于口腔护理制剂的组织等效物可被收集并进行组织学评估。
PDMS 因光学透明、气体通透性好、生物相容性高,成为牙周微流控芯片的核心材料。芯片制备需经多步工艺:首先通过光刻胶模具(如 SU8 光刻胶)制作微通道模板,再采用 PDMS 浇筑工艺复刻微结构;对于需高气密性的结构,需通过阳极键合将 PDMS 与玻璃基底结合;部分芯片还需集成微纳加工平台,实现微柱、微筛网等精细结构的制造,用于细胞捕获或生物膜分层培养。此外,PDMS 烘箱与PDMS 热板用于 PDMS 的固化成型,确保芯片结构的稳定性与一致性。
2) 细胞培养与微生物共培养技术
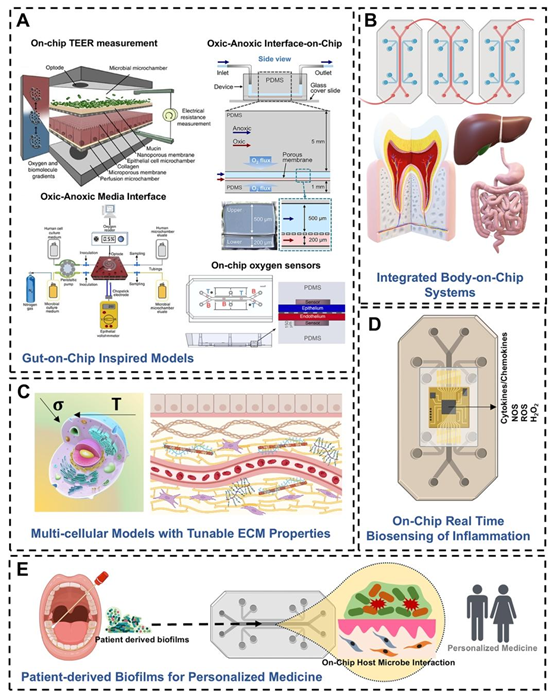
机械性能。(D)在器官芯片系统中集成生物传感器,用于实时生物传感牙周炎症介质。(E)在芯片上培养患者来源的生物膜,以加强疾病建模、药物发现和筛选以及个性化牙科医学。图A展示的是宿主细胞所经历的应力、张力和压缩,以及未来的器官芯片模型如何能够在具有可调性的人工细胞外基质中培养细胞,这些基质中整合了用于评估上皮屏障完整性的跨上皮电阻电极、有氧-缺氧界面的建立,以及用于与宿主细胞一起培养和监测厌氧微生物的氧传感器。(B)集成的人体芯片(BoC)系统,用于模拟牙周与全身的相互作用,整合了口腔和远处器官(如肠道和肝脏)的组件。(C)细胞外基质诱导的机械信号,如剪切力。图10 用于研究牙周宿主-微生物相互作用的器官芯片系统开发的未来方向。(A)肠道芯片模型改编自参考文献168(根据CC-BY许可)、参考文献114(根据CC-BY许可)以及参考文献115(经施普林格·自然有限公司许可,©2019)。图B-E由https://Biorendor.com制作。
牙周芯片的核心价值在于支持宿主 – 微生物的长期共培养。通过优化培养基配方与芯片结构,可实现多种细胞类型的共培养:如牙龈上皮细胞、成纤维细胞与内皮细胞的分层培养,构建血管化牙龈组织;或3D Cell Culture Chip支持类器官的形成,如微流控类器官芯片可诱导干细胞分化为牙周类器官,具备上皮 – 间质双层结构与牙周特异性标志物表达。
在微生物共培养方面,芯片可通过 “分区设计” 实现宿主细胞与微生物的物理隔离但化学通信 —— 如通过多孔膜分隔宿主细胞区与微生物区,允许小分子信号(如炎症因子、微生物代谢产物)的扩散,同时避免微生物过度增殖对宿主细胞的毒性作用。这种设计已成功用于多器官芯片的共培养,如将牙周芯片与肠道芯片连接,研究牙周致病菌代谢产物对肠道屏障功能的影响,为解析 “牙周 – 系统疾病” 关联提供了体外模型。
5. 未来方向:跨系统融合与个性化研究
牙周微流控器官芯片技术仍在快速发展,未来将聚焦三大方向:
- 多系统集成模型:借鉴肠道芯片的成功经验,构建 “牙周 – 肝脏 – 心血管” 多器官芯片系统,模拟牙周致病菌及其代谢产物通过血液循环影响远端器官的过程,解析牙周病与系统性疾病的关联机制。
- 个性化模型构建:利用患者来源的细胞(如牙龈成纤维细胞、牙周韧带干细胞)与口腔菌群,制备个性化牙周芯片,评估患者对不同抗菌药物、益生菌的反应,为精准牙周治疗提供依据。
- 实时监测技术融合:在芯片中集成 biosensor(如氧传感器、炎症因子检测传感器),实现对微生物代谢、宿主炎症反应的实时动态监测,减少实验取样对模型的破坏,提升数据的连续性与准确性。
从 3D 器官型培养到微流控器官芯片,牙周病体外模型逐步实现了对牙周微环境的 “结构 – 功能 – 动态” 三重复刻。依托 PDMS 芯片、MEMS 加工、光刻等核心技术,结合细胞共培养芯片、多器官芯片的设计理念,这些先进模型不仅为解析牙周宿主 – 微生物相互作用提供了更精准的工具,还为牙科材料筛选、治疗药物研发提供了高效平台。随着技术的不断迭代,牙周微流控芯片将进一步推动牙周病基础研究向临床转化的效率,为全球牙周健康问题提供创新解决方案。
参考文献:DOI: 10.1039/d4lc00871e
Dxfluidics Products
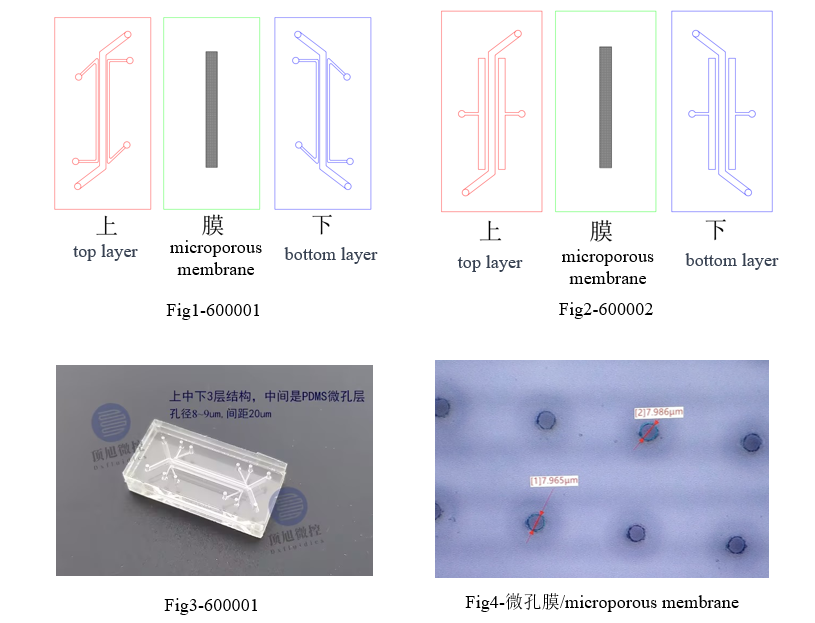
| Product Code | Outline (mm) | Channel | Microporous membrane | Material | Price (CNY) | |||
| Height (mm) | Width (mm) | Space (mm) | Thickness (um) | Hole diameter (um) | ||||
| 600001 | 30*15 | 0.5 | 1 | 0.2 | 25 | 8 | PDMS | 800 |
| 600002 | 30*15 | 0.5 | 1 | 0.5 | 25 | 8 | PDMS | 800 |
Ordering Methods



© 2026. All Rights Reserved. 苏ICP备2022036544号-1













