1. 引言:癌症研究的困境与器官芯片技术的崛起
癌症作为全球主要致死疾病之一,其复杂的肿瘤微环境(TME)和模糊的分子机制长期制约着有效治疗方案的开发。传统 2D 细胞培养无法模拟体内动态生理微环境,动物模型则存在物种差异导致的临床转化效率低等问题 —— 这些痛点推动了organ chip(Organ-on-a-chip, OoC) 技术的快速发展。作为融合微流控技术、生物材料与细胞生物学的跨学科成果,器官芯片能够精准复刻人体器官的结构与功能,尤其在癌症芯片(Cancer-on-chip) 领域,为癌细胞建模、药物筛选和个性化治疗提供了全新平台。
在这一技术体系中,Chip是核心载体,其加工依赖MEMS 加工技术与微纳加工平台,常见的芯片材料如PDMS (polydimethylsiloxane) 凭借良好的生物相容性和透气性,成为制备PDMS 微流控芯片、PDMS 模具的首选材料。从PDMS 芯片制备到微流道加工,从光刻胶模具到紫外掩膜光刻机的应用,每一步工艺都为器官芯片的功能实现奠定基础,也让模拟肿瘤微环境中的细胞互作、营养传输和药物扩散成为可能。
2. 器官芯片(OoC)技术:原理、材料与核心工艺
1) OoC 技术的核心原理
器官芯片的本质是 “微型化人体器官模型”,通过在Chip中构建含活细胞的中空微通道,复刻器官的多细胞结构、化学梯度与机械信号。文献中提到,OoC 系统主要通过三种灌注策略实现器官功能模拟:一是多器官模块通过外部微通道连接,可灵活开关流体;二是单芯片集成多流体腔室,每个腔室培养特定细胞类型;三是将复杂器官模型(如肝脏)集成到单芯片,通过多孔膜实现细胞间通讯。这种设计能够精准模拟体内器官的生理状态,远超传统 2D 培养的局限性。
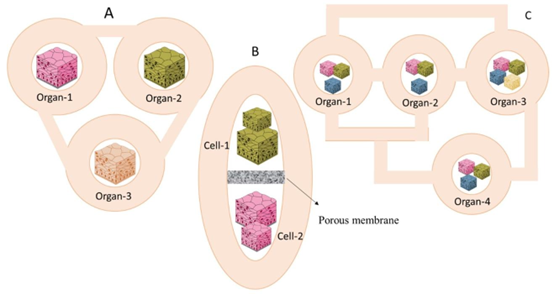
器官芯片灌注系统的三种策略:A 这种设计允许通过外部通道/管道简单直接地连接多个器官模块,选择性地切换单个芯片的流量(开/关),或者通过外部流体阀引导流量。B 在这种设计中,芯片包含多个流体腔室,每个腔室容纳特定的器官、组织或均质单细胞培养物。C 这种设计允许将相对复杂的单个器官模型(例如肝脏)集成到单个芯片上,改编自参考文献[19]。A 创建多个简单的微流体腔室/芯片,每个都包含通过微通道或管道连接的细胞单培养物。这种设计允许通过外部通道/管道简单直接地连接多个器官模块,选择性地切换单个芯片的流量(开/关),或者通过外部流体阀引导流量[20,21]。此外,模块可以在所需的时间点以及细胞分化后进行连接/断开。然而,这种设计中的细胞类型配置无法模拟体内配置,其中不同细胞类型之间的细胞-细胞界面距离(通道/管道)相对较大[20,21]。B 在单个芯片上集成多个器官。在这种设计中,芯片包含多个流体腔室,每个腔室容纳特定的器官、组织或均质单细胞培养物。每个腔室可以在单个或多个隔室中容纳一种或两种细胞类型(例如,两个加载的隔室分隔的腔室通过物理或生物屏障连接,确保器官之间的持续通信。每个具有2-3个流体隔室的简单器官芯片可以通过软管和阀门的外部连接进行集成。这种设计允许将相对复杂的单个器官模型(例如肝脏)集成到单个芯片上,或者将多个器官模块集成到灌注系统中[19,24]。器官芯片试验和必要条件的高级路线图,从规模考量和扩展阶段的进展开始,涉及设备开发、细胞化、灌注和自动化以及验证要求,然后进入符合特定法规、标准化的转化阶段,并提供一定程度的易见性,这可能会促进器官芯片的更广泛采用。图2展示了器官芯片试验和必要条件的高级路线图,通过模拟特定器官的多孔膜实现[22,23]。C 流体
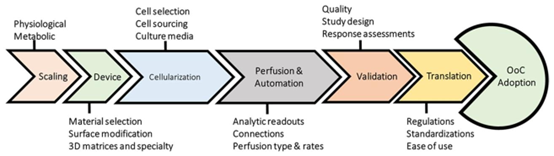
器官芯片试验及必要条件的高级路线图,这是一个转化阶段,允许特定的法规、标准化,并提供一定程度的易见性,可促成更完善的器官芯片。该阶段从规模考量开始,历经开发阶段,包括设备扩展、细胞化、批准前融合与自动化,以及在达成之前的验证必要条件(改编自参考文献[25])。
2) 关键材料与加工工艺
OoC 技术的落地离不开核心材料与加工设备的支撑。PDMS作为主流芯片材料,其加工需借助PDMS 加工设备完成浇筑、键合与打孔 —— 例如使用PDMS 浇筑器制备芯片基底,通过PDMS 等离子键合机实现芯片层间密封,搭配PDMS 打孔器加工流体进出口。为提升细胞黏附性,芯片表面常需进行surface modification,如PEG 修饰载玻片、氨基修饰或醛基化修饰玻片,这些修饰工艺能模拟肿瘤微环境中的细胞外基质(ECM)特性,优化癌细胞与基质细胞的共培养效果。
在芯片加工环节,MEMS 加工技术贯穿始终:从微纳加工实验室的electron beam lithography (EBL)到deep silicon etching,从光刻胶模具制备到SU8 模具(虽部分暂停推广,但仍是传统工艺重要组成)的应用,均需依赖光刻机设备 —— 如桌面式光刻机、紫外光刻机可实现微米级精度的微通道图案化,而微纳加工平台则为多步骤工艺提供集成化支持。这些工艺不仅保障了Chip的结构精度,也为3D Cell Culture Chip、organoid chip的功能实现提供了硬件基础。
3. 肿瘤微环境(TME)的芯片级复刻:从细胞互作到功能模拟
肿瘤微环境是癌症发生、发展的关键场景,其包含癌细胞、基质细胞(如癌症相关成纤维细胞 CAFs、内皮细胞)及 ECM 等成分。器官芯片技术通过3D Cell Culture Chip与细胞共培养芯片的设计,成功实现了 TME 的动态模拟,解决了传统模型无法还原细胞异质性与微环境互作的难题。
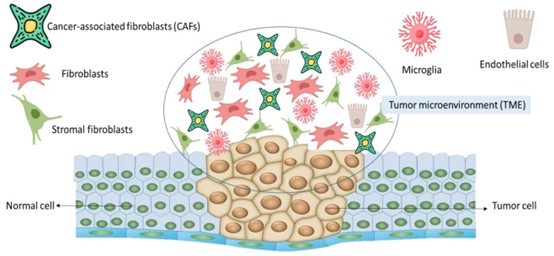
肿瘤微环境(TME)示意图。如图所示,癌相关成纤维细胞(CAFs)、小胶质细胞、内皮细胞、成纤维细胞和基质成纤维细胞是肿瘤微环境中的主要细胞。
1) 细胞层面的精准复刻
文献中提到,乳腺癌芯片模型通过共培养 iPSC 诱导的心肌细胞与乳腺癌细胞,成功监测化疗药物(如多柔比星)的心脏毒性;而肝器官芯片、肺器官芯片则能模拟特定器官中肿瘤的生长特性 —— 例如在肝器官芯片中,通过PDMS 芯片构建的 3D 微环境,可观察肝癌细胞与肝细胞的互作及药物代谢过程。此外,3D 类器官细胞培养技术的融入,让芯片模型能够还原肿瘤的异质性,如类器官微流控芯片可培养患者来源的类器官,为个性化治疗提供依据。
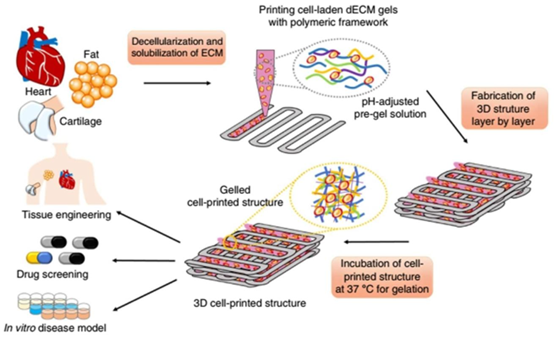
利用脱细胞细胞外基质生物墨水打印3D组织类似物。如图所示,分离的组织经过脱细胞处理后,在酸性条件下溶解,并调节至生理pH值[80],通过物理、化学和酶学方法相结合进行收获。
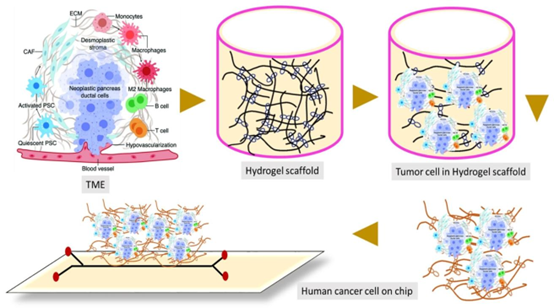
癌细胞中的水凝胶支架。基于支架或水凝胶的支架可以模拟抗原呈递细胞(APCs)直接扩增原代T细胞,改良的过继细胞移植能够以持续的方式释放成熟树突状细胞(DCs)或嵌合抗原受体T细胞(CAR-T细胞),并维持细胞的活力。功能化的(内容来源于参考文献[84])
2) ECM 与机械信号的模拟
为模拟 TME 中的 ECM 特性,器官芯片常采用hydrogel(水凝胶) 作为支架材料,如文献中提到的 GelMA(甲基丙烯酰明胶)与脱细胞肝基质(DLM)复合水凝胶,其性能可通过surface modification进一步优化 —— 例如通过亲水修饰提升水凝胶的细胞相容性,或通过长效疏水处理模拟特定组织的物理特性。同时,芯片的机械信号模拟依赖微流控芯片泵的精准灌注,通过控制流体流速模拟体内血液流动,激活癌细胞的机械感知通路,还原肿瘤侵袭与转移的生理过程。
4. 微流控技术:器官芯片的 “血管系统” 与功能延伸
微流控技术是器官芯片的核心驱动力,其通过微流道加工、微流控芯片设计与精准流体控制,为芯片模型提供 “血管系统” 般的支持,实现营养传输、药物梯度构建与实时监测。
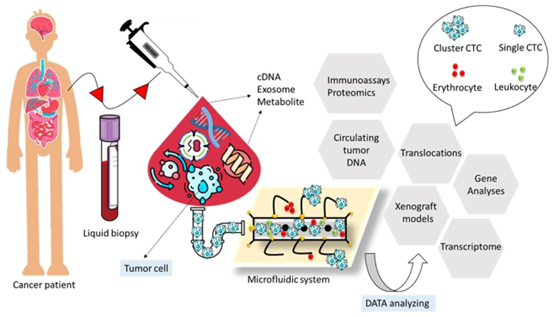
用于癌细胞诊断的集成微流控装置示意图,微流控系统中使用了不同的数据分析方法,如免疫测定蛋白质组学、基因分析和转录组学,改编自参考文献[42]
1) 微流控系统的核心功能
在癌症芯片中,Chip的微通道不仅是流体传输通道,更是构建药物浓度梯度、模拟体内生理屏障的关键。例如,文献中提到的结直肠癌芯片通过微流控浓度梯度芯片实现药物(如纳米载药系统)的梯度递送,观察癌细胞的剂量依赖性反应;而血脑屏障芯片则通过微通道构建内皮细胞 – 星形胶质细胞共培养模型,评估药物穿透血脑屏障的能力。这些功能的实现,离不开微流控芯片加工的高精度 —— 如微纳加工技术打造的微米级微通道,以及微流控芯片夹具保障的流体密封性。
2) 与 MEMS 技术的协同创新
MEMS 微流控系统的融入进一步拓展了器官芯片的功能边界。例如,通过MEMS 代工加工制备的微型传感器,可集成到Chip中,实时监测芯片内的葡萄糖浓度、氧分压与细胞因子水平;而MEMS 热导技术则可精准控制芯片温度,模拟人体体温环境。此外,微流控芯片检测仪器的搭配使用,如基于微流控芯片的数字 PCR Device,能快速分析癌细胞的基因表达变化,为药物敏感性评估提供数据支持。
5. 器官芯片在癌症药物敏感性建模中的应用:从筛选到临床转化
药物开发是器官芯片技术的核心应用场景之一。传统药物筛选依赖动物模型,存在周期长、成本高、临床转化率低等问题,而癌症芯片通过模拟人体生理环境,能显著提升药物筛选的精准性,加速临床转化进程。
1) 精准药物筛选与毒性评估
文献中提到,卵巢癌 – 肝脏多器官芯片模型通过共培养卵巢癌细胞(A2780)与肝细胞(HepG2),同时评估顺铂的抗肿瘤 efficacy 与肝毒性,解决了传统模型无法同步监测 “疗效 – 毒性” 的痛点。这类模型的构建需依赖微流控药筛芯片产品,搭配微流控芯片检测仪器实现细胞活力、凋亡率与代谢产物的实时分析。此外,PDMS Chip的透明特性便于通过显微镜观察癌细胞形态变化,如文献中提到的胶质母细胞瘤芯片,可通过活细胞成像观察肿瘤 spheroid 对替莫唑胺的响应。
2) 个性化治疗的落地支撑
器官芯片技术为个性化治疗提供了新路径。通过Mcirofluidic Chip,可将患者来源的癌细胞或类器官集成到芯片中,构建 “患者专属芯片模型”。例如,文献中提到的乳腺癌芯片通过分析患者肿瘤细胞的 P53 与 BRCA1 状态,预测其对化疗药物的敏感性;而类器官微流控芯片则能培养患者来源的肠道类器官,评估靶向药物的疗效。这类应用离不开微流控芯片代工服务的支持,如通过MEMS 代加工制备个性化芯片结构,或通过Customized Fabrication of Microfluidic Chips优化细胞培养腔室设计。
6. 挑战与未来展望:器官芯片技术的产业化路径
尽管器官芯片技术在癌症研究中展现出巨大潜力,但其产业化仍面临挑战:一是加工成本高,PDMS 模具、光刻机等设备价格昂贵,需通过微流控芯片代工规模化降低成本;二是标准化不足,不同实验室的芯片设计与工艺差异较大,需建立统一的Chip生产标准;三是功能集成度待提升,如实时监测传感器的灵敏度、多器官芯片的流体控制复杂度仍需优化。
未来,器官芯片技术的发展将围绕三大方向:一是3D 生物打印与芯片技术的融合,通过生物打印制备复杂器官模型,搭配PDMS 模具实现高精度结构;二是微流控芯片系统的集成化,如将微流控芯片泵、传感器与检测模块集成到便携设备,提升临床适用性;三是多器官芯片的协同优化,如构建 “肿瘤 – 肝脏 – 肾脏” 多器官模型,全面评估药物的体内代谢与毒性。这些方向的推进,将进一步巩固器官芯片在癌症研究与精准治疗中的核心地位。
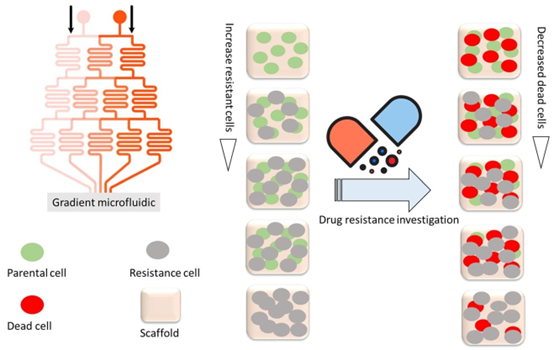
用于创建耐药性研究3D肿瘤模型的器官芯片(OoC)平台,如图所示,通过简单地将肝癌亲本细胞和耐药细胞梯度注射到微流控芯片中,即可实现具有不同程度耐药表型的肿瘤模型。这个器官芯片平台将为组装提供新的思路(改编自参考文献[89])。
器官芯片(OoC)技术作为微流控与生物医学交叉创新的成果,正彻底改变癌症建模与药物开发的范式。从PDMS Chip的精准加工到3D Cell Culture Chip的 TME 复刻,从organoid chip的个性化应用到MEMS 微流控系统的功能延伸,每一项技术突破都推动着癌症研究向 “精准化、临床化” 迈进。随着Mcirofluidic Chip、器官芯片加工设备的规模化发展,以及标准化体系的建立,器官芯片必将成为连接基础研究与临床治疗的关键桥梁,为癌症患者带来更高效、更安全的治疗方案。
参考文献:https://doi.org/10.1007/s11517-024-03199-5
Dxfluidics Products
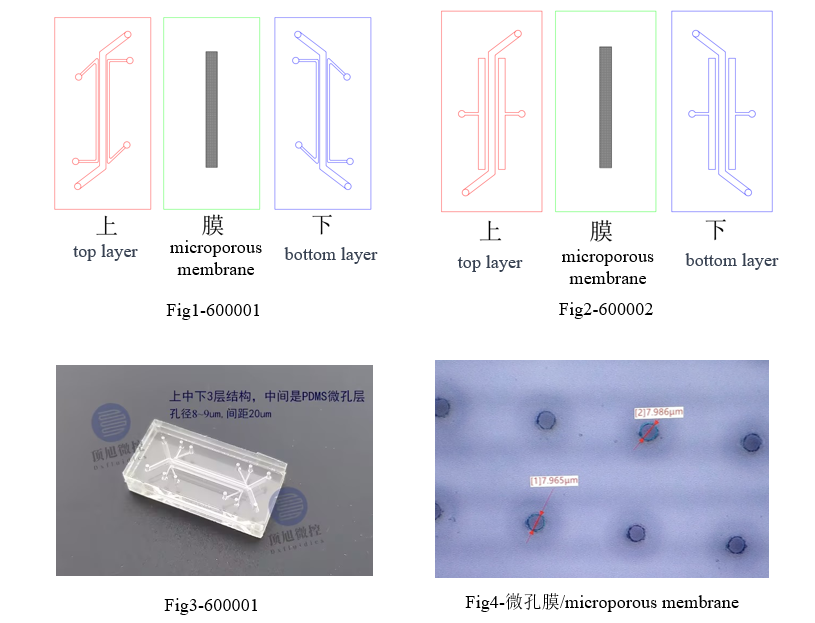
| Product Code | Outline (mm) | Channel | Microporous membrane | Material | Price (CNY) | |||
| Height (mm) | Width (mm) | Space (mm) | Thickness (um) | Hole diameter (um) | ||||
| 600001 | 30*15 | 0.5 | 1 | 0.2 | 25 | 8 | PDMS | 800 |
| 600002 | 30*15 | 0.5 | 1 | 0.5 | 25 | 8 | PDMS | 800 |
Ordering Methods



© 2026. All Rights Reserved. 苏ICP备2022036544号-1













