1. 引言:蛋白质组学分析的技术瓶颈与微流控革新
基于质谱(MS)的蛋白质组学分析已成为生物医学领域揭示疾病机制、筛选标志物的核心技术,尤其在癌症分型等精准医疗应用中展现出巨大潜力。然而,传统 “自下而上” 的分析流程中,样本处理步骤繁琐、反应容器更换频繁、样本转移过程中的非特异性吸附等问题,导致低丰度蛋白质样本易丢失、污染风险高,严重限制了分析的灵敏度与重现性。
微流控技术的崛起为解决这一痛点提供了新路径,其中数字微流控(DMF)凭借皮升至微升尺度的液滴操控能力,实现了样本与试剂的精准混合、反应与转移。结合 MEMS 加工工艺的精密制造优势,以及 PDMS 芯片优良的生物相容性与加工灵活性,数字微流控系统逐渐成为蛋白质组学样本处理的理想平台。本文聚焦 2023 年发表于《Chemical Science》的 “All-in-One” 数字微流控管道技术,深入解析其技术创新、核心优势及在癌症分型中的应用,展现微流控芯片与蛋白质组学交叉融合的行业价值。
2. 技术核心设计:全流程集成的数字微流控系统架构
1) DMF 装置与液滴操控机制
该系统的核心是基于 PDMS 材料的数字微流控芯片,通过光刻工艺在芯片底部构建电极阵列,顶部覆盖含微孔洞的 ITO 导电玻璃作为对电极,中间以疏水修饰的介质层分隔,形成液滴操控通道。借助 DropBot 控制系统与 MicroDrop 软件,通过施加交流电位驱动液滴在电极阵列上移动、合并与混合,实现样本处理全流程的自动化控制。
PDMS 芯片的加工过程融合了微纳制造技术的关键环节,包括光刻胶模具制备、PDMS 浇筑成型、键合对准等工艺,确保芯片电极间距均匀、液滴移动顺畅。芯片表面的疏水修饰处理(接触角≥115°)有效减少了蛋白质吸附造成的样本损失,为低丰度样本分析提供了基础保障。
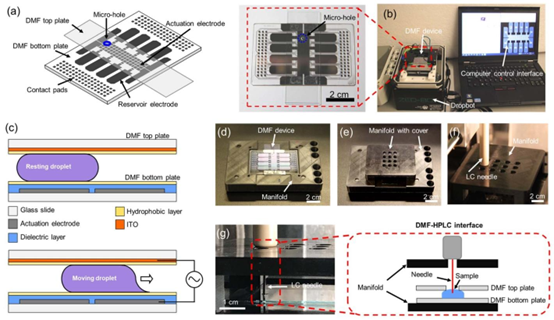
图1 用于蛋白质组学样品处理和分析的一体化数字微流控(DMF)管道。(a)此处使用的DMF装置示意图,包括底板和带有采样微孔(蓝色)的顶板。(b)与开源DropBot控制系统和运行开源MicroDrop程序的计算机相连接的DMF装置照片。插图:DMF装置的特写照片。(c)DMF装置的示意图(侧视图),展示了DMF装置的组成部分,包括玻璃基板(白色)、底板上的驱动电极(灰色)、底板上的介电层(蓝色)、疏水层(黄色)以及顶板上的氧化铟锡(ITO)对电极(橙色)。当未施加电势时(上方),液滴静止不动。当向特定的驱动电极施加电势时(下方),液滴会移动到该电极上。(d)无定制盖和(e)有定制盖的定制化DMF自动进样器 manifold照片。(f)manifold顶盖的照片,其上带有支持自动进样器注射针的采样阵列孔。(g)展示DMF-HPLC接口中采样过程的照片和示意图(插图)。
2) HPLC-MS 接口的创新优化
为解决传统 DMF 系统与高效液相色谱 – 串联质谱(HPLC-MS/MS)衔接时的手动转移痛点,研究团队设计了 3D 打印的 DMF – 自动进样器接口。该接口采用标准多孔板尺寸,兼容主流 HPLC 仪器,通过精准定位的采样孔引导进样针与 DMF 芯片的微孔洞对接,实现处理后样本的自动化抽吸与进样。
与传统锥形孔板相比,PDMS 芯片的平面底部设计在优化后展现出 98.9% 的装载效率,且无明显液滴残留,完美解决了微流控系统与质谱分析的衔接瓶颈,形成 “样本处理 – 分离分析” 的闭环自动化流程。
3) 多模块协同的温度与反应控制
蛋白质组学样本处理涉及还原、烷基化、酶解等多步反应,对温度控制精度要求极高。系统集成了两套加热单元:辅助加热器用于 70℃下的二硫键还原反应,实现快速升温和降温以减少蒸发;内置电阻加热器用于 37℃的胰蛋白酶酶解反应,通过脉冲宽度调制(PWM)技术精准控温。
两套加热单元的协同工作,结合 DMF 芯片的微尺度传热优势,显著提升了反应动力学稳定性,为后续同位素标记的精准定量奠定了基础。同时,芯片的封闭设计减少了外界污染,进一步保障了分析结果的重现性。
3. 关键技术优化:从试剂适配到流程整合的突破
1) 表面活性剂浓度的精准调控
表面活性剂在蛋白质溶解、减少吸附及提升酶解效率中发挥关键作用,但需同时满足 DMF 液滴操控与 MS 检测兼容性。研究团队针对常用的 n – 十二烷基 -β-D – 麦芽糖苷(DDM),通过力 – 速度曲线分析优化浓度至 0.0025%(wt/wt),该浓度下液滴移动速度最快、饱和力最大,且不会抑制 MS 信号。
这一优化既解决了传统高浓度表面活性剂导致的液滴黏附问题,又兼顾了蛋白质组学分析的检测灵敏度,为微流控芯片在低丰度样本处理中的应用提供了关键技术支撑。
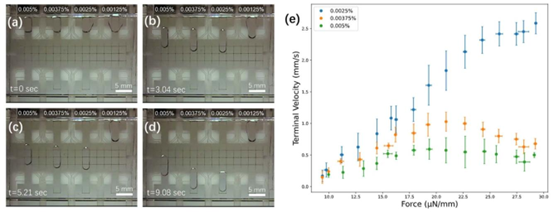
图2 DDM浓度对液滴运动的影响。补充视频S1†中的帧图展示了含有DDM(0.0025%、0.00375%和0.005% 重量比)的水性液滴在(a)0秒(加载阶段)、(b)3.04秒、(c)5.21秒和(d)9.08秒时的运动情况。(e)三种最高测试浓度的力-速度曲线(0.0025%——蓝色,0.00375%——橙色,0.005%——绿色)。误差线为每种条件下\(n=3\)次重复实验的±1标准偏差。
2) 全流程自动化的 “All-in-One” 管道
该技术首次实现了蛋白质组学分析全流程的集成自动化,涵盖 9 个核心步骤:样本加载、二硫键还原、烷基化、酶解、同位素标记、反应淬灭、样本混合、酸化处理及 HPLC-MS 进样。整个流程无需人工干预,通过软件编程控制液滴在电极阵列上的移动路径,实现多样本的并行处理。
其中,同位素标记模块整合了轻、中、重三种二甲胺标记试剂,可对不同样本进行差异化标记后混合分析,显著提升了相对定量的准确性。这种 “并行处理 – 混合分析” 模式,结合 PDMS 芯片的微型化优势,大幅降低了样本用量(纳克级),特别适用于临床珍贵样本的分析。
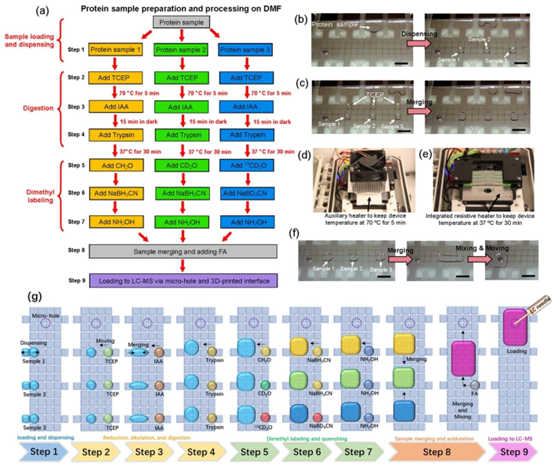
图3 一体化数字微流控蛋白质组学流程。(a) 一体化流程的工作流程图,包括样品加载(步骤1)、还原(步骤2)、烷基化(步骤3)、酶解(步骤4)、同位素标记和淬灭(步骤5-7)、处理后样品合并(步骤8)以及加载到高效液相色谱-质谱联用仪(步骤9)。分别用橙色、绿色和蓝色表示用轻质量标签、中质量标签和高质量标签标记的样品。展示流程中各个步骤的照片,包括(b)步骤1、(c和d)步骤2、(e)步骤4和(f)步骤8。(g) 展示整个工作流程的示意图。
3) 与 MEMS 加工的深度融合
系统的精密制造依赖 MEMS 加工技术的支撑,包括电极阵列的光刻与蚀刻、PDMS 芯片的模具成型与键合对准、3D 打印接口的精密制造等。通过 MEMS 加工工艺实现的微尺度结构,确保了液滴操控的精准性与系统的稳定性,使芯片能够批量生产且性能均一。
同时,芯片的模块化设计允许根据不同应用场景更换功能单元,例如针对细胞培养样本的专用反应区域、针对组织样本的预处理模块等,展现出良好的灵活性与扩展性。
4. 临床应用验证:癌症分型中的技术价值凸显
1) 乳腺癌细胞系的蛋白质组学差异分析
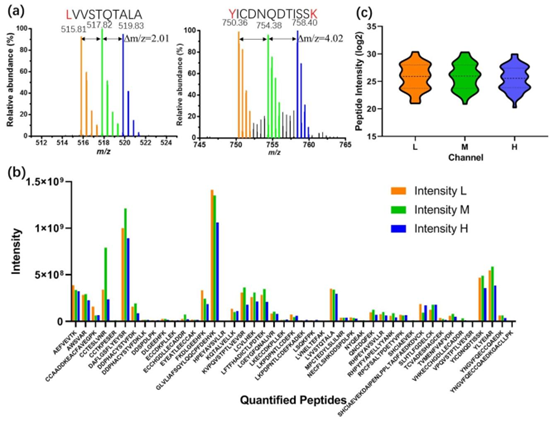
图4 DMF上All-in-One管道处理的BSA样品的二甲基标记(每个通道1纳克BSA)。(a)LVVSTQTALA(左)和YICDNQDTISSK(右)的提取质谱图,分别带有轻标(橙色)、中标(绿色)和重标(蓝色)。(b)45种定量肽各自的强度分布,这些肽带有轻标(L,橙色)、中标(M,绿色)和重标(H,蓝色)。(c)轻标(L,橙色)、中标(M,绿色)和重标(H,蓝色)通道的定量肽强度(log 2)分布的小提琴图。
研究团队采用该系统对两种乳腺癌细胞系(MCF-7 和 MDA-MB-231)进行分析,通过同位素标记实现了 973 种蛋白质的鉴定,其中 597 种蛋白质可进行定量比较。结果显示,MCF-7 细胞中激素响应相关蛋白(如 HSP90AB1、HSPB1)表达上调,而 MDA-MB-231 细胞中糖酵解相关蛋白(如 LDHA、ENO1、PGK1)及间质表型相关蛋白(如 KRT18、AKR1C2)表达显著升高,与已知的细胞生物学特性高度一致。
系统的高重现性(通道间相关系数≥91.5%)与精准定量能力,为癌症细胞表型的蛋白质组学表征提供了可靠工具,也为细胞培养芯片与蛋白质组学分析的结合提供了实践范例。
2) 人体乳腺组织样本的癌症分型应用
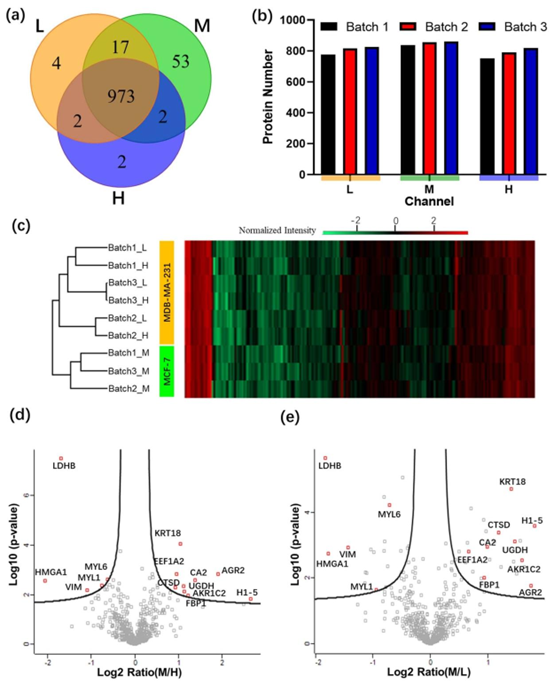
图5 使用一体化DMF管道对细胞裂解物进行二甲基标记。(a) 从三批轻(“L”,MDA-MB-231细胞)、中(“M”,MCF-7细胞)和重(“H”,MDA-MB-231细胞)通道中鉴定出的蛋白质的维恩图。(b) 三批样本在轻(“L”)、中(“M”)或重(“H”)通道中每个通道鉴定出的蛋白质数量的图表。(c) 597种定量蛋白质(列)在9个样本(行)中各自的热图,包括三批轻(“L”)、中(“M”)和重(“H”)通道样本。红色、黑色和绿色阴影分别代表高丰度、中等丰度和低丰度的蛋白质。M/H通道(d)和M/L通道(e)的蛋白质组数据库中所有已鉴定蛋白质的火山图。在两个火山图中,MCF-7和MDA-MB-231之间差异表达的蛋白质用红色方框突出显示。
在临床样本验证中,系统成功分析了健康乳腺组织与不同分期乳腺癌组织样本,鉴定出 882 种蛋白质,其中 436 种可定量。与健康组织相比,癌症组织中 31-56 种蛋白质存在差异表达,包括 PGS2、UGDH、ASPN 等已知乳腺癌相关蛋白。此外,转移性与非转移性肿瘤组织间的 27 种差异表达蛋白(如 CTSD、KRT18),为癌症进展阶段的判断提供了潜在标志物。
这些结果表明,该系统能够有效处理临床组织样本,为癌症亚型分类、预后评估提供精准的蛋白质组学数据,展现出在临床诊断中的巨大应用潜力。同时,系统对微量样本的高效处理能力,与类器官芯片、3D 细胞培养芯片的样本输出需求高度契合,为 “芯片培养 – 蛋白分析” 的一体化平台构建奠定了基础。
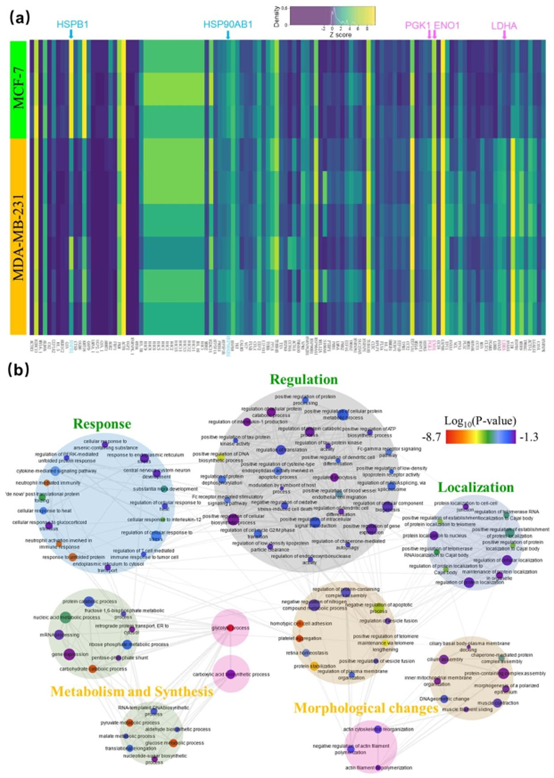
图6 使用All-in-One DMF管道测定的MCF-7和MDA-MB-231之间已识别的变异性最大蛋白质的分析。(a) 9个细胞裂解物样本(行)中发现的118种差异表达蛋白质(列)的图谱。黄色、绿色和深灰色阴影分别代表高丰度、中等丰度和低丰度的蛋白质,与激素通路相关的蛋白质和与糖酵解相关的蛋白质分别以浅绿色和粉红色突出显示。(b) (a)中118种蛋白质所代表的生物学过程的图形描述。大圆圈定义过程分组,标记定义特定过程,标记颜色代表报告蛋白质功能分配统计置信度的\(log10(p\)值(红色表示低,紫色表示高),标记大小代表基因本体论(GO)术语在基础基因本体论注释(GOA)数据库中的出现频率,灰色线条表示特定过程之间的关系。
5. 行业应用前景:从基础研究到临床诊断的全链条赋能
1) 基础研究中的高灵敏度分析
该技术为单细胞蛋白质组学、稀有细胞群体分析等前沿领域提供了新工具。结合微纳加工技术的进一步微型化,未来有望实现单个细胞的蛋白质组学分析,揭示细胞异质性在疾病发生发展中的作用。同时,系统的自动化与并行化能力可大幅提升研究效率,加速蛋白质 – 蛋白质相互作用、信号通路调控等基础研究的进程。
2) 临床诊断中的精准分型与标志物筛选
在癌症、神经退行性疾病等重大疾病的诊断中,该系统可实现微量临床样本(如穿刺组织、体液)的高效分析,筛选特异性生物标志物,辅助疾病早期诊断与分型。结合器官芯片技术,可构建 “疾病模型 – 药物筛选 – 标志物验证” 的一体化平台,推动精准医疗的发展。
3) 技术推广与产业化潜力
该系统的核心组件(PDMS 芯片、3D 打印接口、控制软件)均具备批量生产能力,且兼容现有 HPLC-MS 仪器,降低了行业应用门槛。随着 MEMS 加工工艺的成本降低与表面修饰技术的优化,系统的性价比将进一步提升,有望在科研机构、临床检验中心、制药企业等场景广泛应用。
同时,技术的模块化设计允许与其他微流控功能单元(如细胞分选芯片、免疫富集芯片)集成,拓展应用场景至免疫分析、病原体检测等领域,形成多元化的产品矩阵。
“All-in-One” 数字微流控管道技术通过微流控芯片、MEMS 加工、质谱分析的深度融合,解决了蛋白质组学分析中样本损失、污染风险高、流程繁琐等核心痛点,展现出高灵敏度、高重现性、自动化的技术优势。在癌症分型等临床应用中的成功验证,彰显了该技术从基础研究到临床诊断的转化潜力。
随着微流控技术与蛋白质组学、MEMS 加工、器官芯片等领域的进一步交叉融合,未来有望开发出更微型化、高通量、多功能的集成系统,为精准医疗、药物研发、疾病诊断等领域带来革命性变革。数字微流控技术正以其独特的优势,成为生物医学分析领域的核心支撑技术,推动行业向更精准、更高效、更经济的方向发展。
参考文献:DOI: 10.1039/d3sc00560g
© 2026. All Rights Reserved. 苏ICP备2022036544号-1













