1. 抗生素耐药性危机与微流控技术的崛起
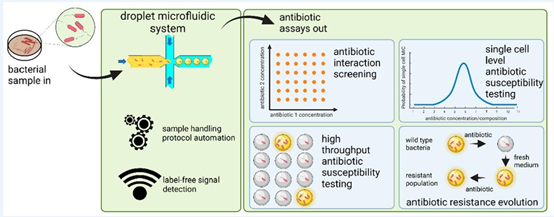
抗生素耐药性已成为全球公共卫生领域的重大威胁,据世界卫生组织预测,到 2050 年, antimicrobial-resistant 感染每年将导致 1000 万人死亡,远超当前新冠疫情的影响。传统抗生素敏感性检测(AST)方法存在通量低、耗时久、精度不足等问题,难以满足临床快速诊断和药物研发的需求。在此背景下,微流控芯片技术凭借其微型化、集成化、高通量的核心优势,成为破解抗生素耐药性检测难题的关键方向,而液滴微流控作为微流控技术的重要分支,更是实现单细菌水平精准分析的核心手段。
液滴微流控技术通过将含菌液与抗生素的水溶液分散在油相介质中,形成纳升至皮升量级的微小液滴,每个液滴可作为独立的反应单元,实现数百万个并行检测。这种技术不仅大幅降低样本与试剂消耗量,还能精准控制反应条件,为单细胞分析、耐药性进化追踪等提供了前所未有的技术支撑。基于 PDMS 材料的微流控芯片凭借优良的生物相容性与加工灵活性,成为液滴微流控系统的核心载体,其制备过程可通过光刻胶模具成型、等离子键合等 MEMS 加工工艺实现,配合微纳加工技术的精准控制,可实现液滴生成、混合、孵育、检测的全流程自动化。
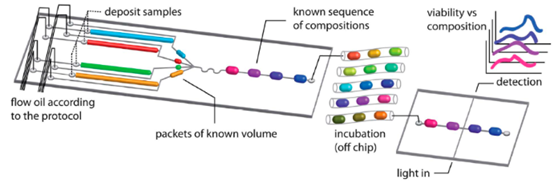
2. 液滴微流控抗生素检测的自动化方案
1) 流动液滴筛选系统
为实现抗生素组合效应的高通量分析,研究团队开发了基于流动液滴的自动化筛选系统。该系统通过微流控芯片的精准操控,将两种或多种抗生素按不同浓度比例混合,形成序列化液滴文库,再与细菌悬液和生长培养基融合,实现对药物协同、拮抗或累加效应的快速评估。系统采用 MEMS 加工工艺制备的微通道结构,可精准控制液滴体积与混合比例,结合 PDMS 芯片的低吸附特性,有效避免药物与芯片表面的非特异性结合,确保检测准确性。
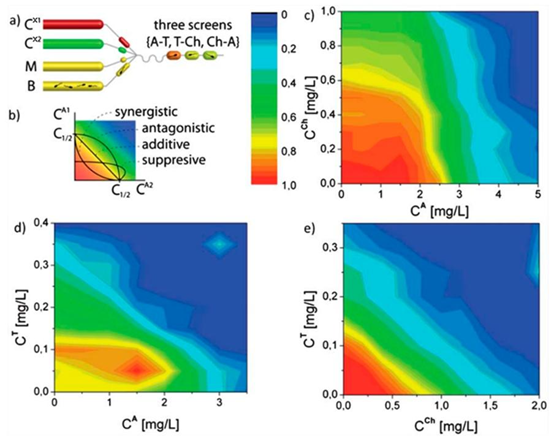
图1. 在微流控装置中以自动化方式测量的两种抗生素的相互作用。(a) 生成液滴以进行抗生素耐药性筛选,所用抗生素为四环素(T)、氯霉素(Ch)和氨苄青霉素(A)。其中一种抗生素的使用浓度为\(C^{x_{1}}\),另一种抗生素的使用浓度为\(C^{x_{2}}\)。抗生素液滴与生长培养基(M)液滴和细菌悬浮液(B)液滴融合。(b) 抗生素相互作用根据Loewe相加性的定义进行描述,并通过细胞活力二维矩阵图(c-e)中的等效线(恒定抑制线)形状来识别。这些细胞活力图(c-e)中的数据点代表含有两种特定抗生素不同比例的液滴。暖色表示液滴中试卤灵的荧光强度高,意味着液滴中的细菌生长,而冷色则表示无生长。经参考文献1许可改编。版权所有2012,英国皇家化学会。
该方案的核心优势在于通过芯片集成的稀释模块,自动生成抗生素浓度梯度,无需人工干预即可完成数百种药物组合的检测。但早期系统存在浓度调节范围有限的问题,难以适配临床样本中未知耐药性的检测需求。为此,研究团队优化了液滴稀释技术,通过动态调节样本与介质的体积比,实现了更宽的浓度动态范围,为临床样本检测奠定了基础。
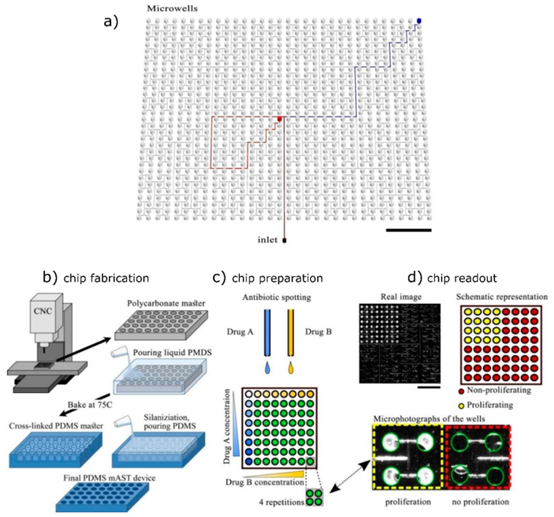
图2.(a)用于抗生素相互作用研究的微孔通过等距通道与入口相连,在通往每个孔的路径上提供相同的水力阻力,从而确保各孔等量填充液体。这些孔通过液滴打印预先填充抗生素,然后让溶剂干燥。接着,在微孔阵列封闭后,通过入口将细菌和培养基加入通道,并由氟化油分隔。(b)微孔板由基于计算机数控铣削母模的聚二甲基硅氧烷(PDMS)制成。(c)通过非接触式打印机向微孔中填充不同浓度的抗生素。(d)左上:细菌生长后的微孔阵列实拍图;右上:有或无细菌增殖的孔的二进制表示;下:有增殖或无增殖细菌的孔的特写。最终装置包含1024个孔。经许可改编自参考文献14,遵循知识共享署名许可协议。版权所有2020年。
2) 打印液滴微腔阵列技术
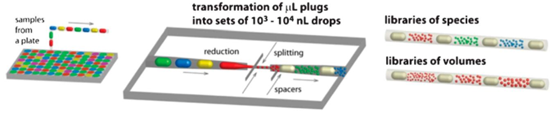
图2. 用于多参数单细胞筛选的液滴库的生成a
针对临床样本检测对宽浓度范围的需求,研究团队提出了基于打印液滴的微流控检测方案。该方案通过非接触式打印技术,将不同浓度的抗生素精准沉积到包含 1024 个微腔的 PDMS 芯片中,溶剂挥发后形成固定浓度的药物阵列。芯片采用 CNC 加工的模具成型,微腔通过等距通道与 inlet 连接,确保细菌悬液注入时的均匀填充。这种离线稀释与芯片集成的模式,结合 MEMS 加工的高精度微结构,实现了抗生素组合检测的规模化与便捷化。
该技术的创新点在于采用一次性 PDMS 芯片设计,配合无泵驱动的自填充机制,无需复杂的压力控制系统,降低了临床应用门槛。同时,微腔阵列支持多参数并行检测,可同步分析细菌对多种抗生素的耐药性,大幅提升检测效率。目前,该系统已实现对四环素、氯霉素等常用抗生素的组合筛查,为临床用药指导提供了快速解决方案。
3. 单细胞水平的抗生素敏感性分析
1) 液滴文库与单细胞封装
单细胞水平的耐药性分析是揭示细菌种群异质性的关键,而液滴微流控技术通过泊松分布原理,可实现单个细菌在液滴中的精准封装。研究团队开发的液滴文库生成系统,将临床样本或细菌培养物分散为数千个纳升液滴,每个液滴仅包含 0-1 个细菌,结合抗生素浓度梯度,形成覆盖单细胞到小种群的检测体系。这种基于 PDMS 芯片的分步乳化技术,通过微流控步乳化模块(MSE)实现液滴的高效生成,配合油相间隔技术,避免了不同浓度组间的交叉污染。
为提升检测通量,系统采用 “母液滴 – 子液滴” 的两级乳化策略,将单个样本分为数百个重复液滴,确保统计显著性。通过这种方法,研究团队成功量化了大肠杆菌对头孢噻肟的单细胞最小抑制浓度(scMIC),发现克隆同源的细菌种群中存在显著的耐药性差异,为理解耐药性进化提供了新视角。
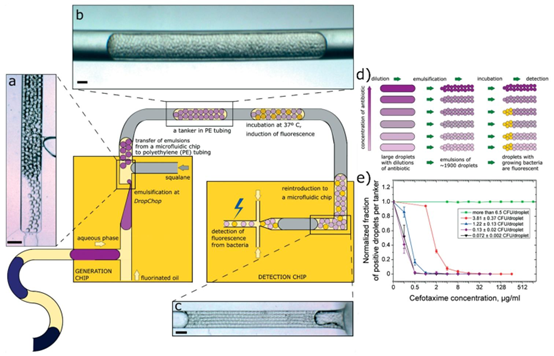
图3. 单细胞最低抑菌浓度(scMIC)舱式测定法。(a−c)舱的生成,即具有不同试剂组成的乳剂在流动中被油间隔物分隔开。(d)乳剂中scMIC实验的概念。(e)通过舱式系统获得的scMIC测量结果。接种效应立即可见:每个液滴中的细菌细胞越多,抑制生长所需的抗生素浓度就越高。scMIC是测量到的最小MIC,正如在另一项批量体积研究中所做的那样。30 经参考文献2许可改编。版权所有2018,英国皇家化学会。
2) 接种效应的精准调控
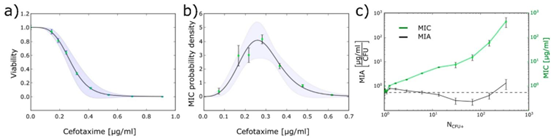
图4. 液滴中的单细胞水平耐药性筛选。(a) 通过基于液滴的单细胞实验获得的\(E.\)的存活曲线。(b) 基于(a)中的曲线得到的单细胞最小抑菌浓度(scMIC)的概率分布。阴影区域显示的是通过将误差传播公式应用于(a)中拟合曲线的负导数所得到的误差。(c) 不同接种密度下测得的最小抑菌浓度(MIC)和最小抑菌量(MIA)(\((N_{CFU+})\))。MIA定义为每细菌的抗生素分子数除以液滴体积后的归一化值。改编自参考文献3,遵循知识共享署名4.0国际许可协议。版权所有2020年。
接种效应(即细菌初始浓度对耐药性检测结果的影响)是传统 AST 方法的主要误差来源之一。液滴微流控技术通过单细胞封装,从根本上消除了接种效应的干扰。研究表明,当液滴中仅含单个细菌时,scMIC 值趋于稳定,而含多个细菌的液滴则需要更高浓度的抗生素才能抑制生长。这种现象提示,单个细菌的耐药性与种群水平存在显著差异,而液滴微流控技术能够精准区分这种差异。
基于这一发现,研究团队开发了兼顾单细胞与种群分析的液滴检测系统,通过控制液滴中细菌浓度,同步获取 scMIC 与传统 MIC 值,为临床诊断提供更全面的耐药性信息。该系统采用细胞培养芯片的设计理念,优化液滴孵育条件,确保细菌在受限空间内的正常生长,配合高灵敏度检测技术,实现了接种效应的量化分析。
4. 光学检测技术的突破与优化
1) 荧光染料的改进与应用
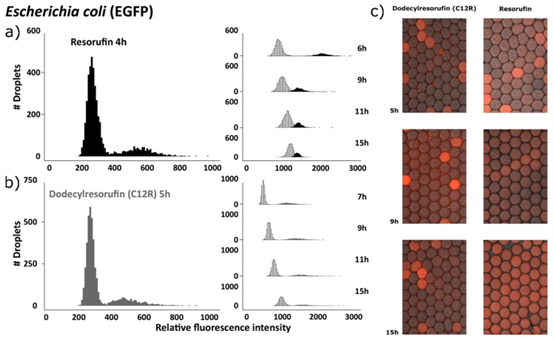
阳性液滴群体,其荧光强度同时降低。(c) 阳性和阴性试卤灵液滴如图5所示:液滴的荧光染料泄漏。(a, b) 两个荧光强度直方图各显示出两个液滴群体:数量较多的阴性液滴群体(不含活细菌,因此不发荧光)和数量较少的阳性液滴群体(含活细菌,因此发荧光)。(a) 当使用试卤灵检测活细菌时,液滴群体荧光强度的时间分辨变化;而在(b)中,十二烷基试卤灵是活力标记物。9小时后,试卤灵的荧光强度群体融合,阳性/阴性群体变得难以区分,而十二烷基试卤灵即使在孵育15小时后,仍能使液滴群体呈现出明显不同的荧光强度。阴性群体的荧光强度随着时间的推移而增加,这是由于几小时后荧光染料从难以区分的液滴中泄漏所致,而十二烷基试卤灵液滴在15小时后形成明显不同的群体。改编自参考文献44。版权所有2016,美国化学会。
细菌生长状态的快速检测是液滴微流控 AST 的核心环节。早期采用的刃天青(resazurin)荧光染料存在易泄漏的问题,导致检测信号失真。研究团队通过筛选发现,十二烷基刃天青(C12R)作为脂溶性荧光探针,可有效减少跨液滴泄漏,在 15 小时孵育后仍能保持清晰的信号区分。这种染料与细菌代谢活动相关,被还原后发出的荧光信号可直接反映细菌存活状态,配合荧光成像技术,实现了数千个液滴的快速筛查。
为适配临床检测的低成本需求,系统采用通用荧光检测模块,无需基因修饰细菌,即可实现对多种致病菌的检测。结合 PDMS 芯片的光学透明特性,荧光信号可通过显微镜物镜高效采集,为高通量筛选提供了技术保障。
2) 无标记散射检测技术
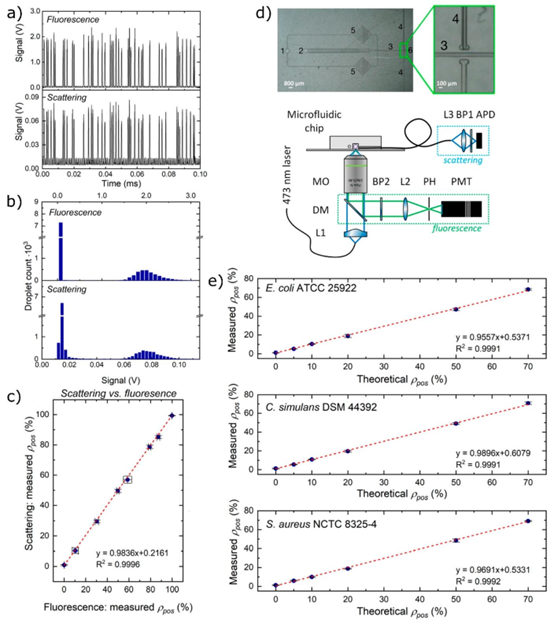
图6. 高通量下液滴中基于荧光和散射的检测。(a) 每个电压峰代表一个流过检测器的液滴。(b) 高电压峰为阳性液滴,在荧光和散射测量中,其形成的群体与阴性液滴明显不同。(c) 对于一种编码了荧光蛋白的细菌菌株,通过两种方法测量得到的阳性液滴百分比。(d) 上图:显示用于液滴筛选的具有流动聚焦结的微流控芯片的显微照片:1,连续相入口;2,液滴入口;3,检测通道;4,光纤引导通道;5,滤光片;6,出口。下图:光学装置示意图:L1,1号透镜;L2,2号透镜;L3,3号透镜;DM,二向色镜;PH,针孔;PMT,光电倍增管;显微镜物镜;BP1,1号带通滤光片;BP2,2号带通滤光片;APD,雪崩光电二极管。(e) 含有不同示例性非荧光细菌菌株的液滴群体中测得的阳性液滴百分比与特定细菌稀释液中阳性信号的理论百分比之间的相关性。改编自参考文献41。版权所有2021美国化学会。
为进一步简化检测流程,研究团队开发了基于光散射的无标记检测系统。该系统利用细菌生长导致液滴内颗粒浓度增加的特性,通过激光散射信号的强度变化判断细菌是否存活。散射检测模块与液滴微流控芯片集成,激光束垂直照射流动的液滴,散射光被垂直方向的光纤收集,转化为电信号进行分析。
该技术的优势在于无需添加荧光染料或基因标记,避免了标记物对细菌生长的干扰,同时检测速度达到 1.2kHz,远超传统荧光检测的通量。系统已成功应用于大肠杆菌、金黄色葡萄球菌等 11 种常见致病菌的检测,散射信号与细菌生长状态的相关性达到 0.99 以上,为临床快速诊断提供了无标记解决方案。结合 MEMS 加工的微型光学组件,该检测模块可实现小型化集成,为便携式检测设备的开发奠定基础。
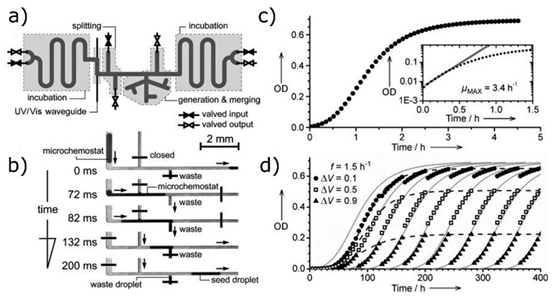
图7.(a)微滴恒化器生成器示意图,包含多个阀门和通道,这些阀门和通道被分组为具有不同功能的部分。该系统可同时控制100多个微滴恒化器。(b)将一个恒化器微滴分裂为一个废弃微滴和一个预定义体积的种子微滴的示意图。该过程通过由特定时刻微滴所在位置的摄像头反馈触发的电磁阀门的仔细开合组合来实现。(c)示例性微型恒化器的细菌生长曲线,插图中显示了最大生长速率(\((\mu_{MAX})\))。(d)在具有不同培养基体积分数(ΔV)的微滴中培养数周的细菌生长曲线。灰线代表描绘莫诺模型的理论曲线。经参考文献4许可改编。2013年约翰·威利父子公司。以频率f周期性交换。
5. 细菌耐药性进化的微流控研究
除了耐药性检测,液滴微流控技术还为细菌耐药性进化研究提供了创新平台。研究团队开发的微流控恒化器系统,通过 PDMS 芯片构建包含 100 余个液滴的培养体系,定期更换含递增浓度抗生素的新鲜培养基,实现细菌的长期连续培养。液滴在封闭管路中循环流动,通过氟油相的高效氧传递,确保细菌在液滴内的正常代谢,支持长达 2 周的耐药性进化追踪。
该系统通过监测细菌生长速率与抗生素浓度的关系,揭示了耐药性突变的积累过程,发现单个细菌的耐药性差异是种群耐药性进化的重要起点。结合单细胞液滴检测技术,可精准捕捉耐药性突变体的出现与扩散,为新型抗生素的研发提供靶点信息。这种基于器官芯片设计理念的长期培养系统,将微流控技术与进化生物学相结合,为理解耐药性产生机制开辟了新路径。
液滴微流控技术在抗生素敏感性检测中的应用,已展现出巨大的临床与科研价值。在临床诊断方面,该技术可将 AST 检测时间从传统的 24-48 小时缩短至 30 分钟至数小时,为重症感染患者的精准用药提供快速指导;在药物研发领域,高通量液滴筛选系统可加速抗生素组合药物的开发,应对多药耐药菌的挑战;在科研领域,单细胞分析与进化追踪功能,为耐药性机制研究提供了前所未有的技术手段。
未来,液滴微流控 AST 技术的发展将聚焦于三个方向:一是临床转化,通过优化 PDMS 芯片的批量生产工艺,降低成本,开发适用于基层医疗机构的便携式检测设备;二是技术集成,将液滴生成、孵育、检测与分选功能集成于单一芯片,实现耐药菌的自动分离与鉴定;三是多维度检测,结合核酸检测、代谢分析等技术,构建 “表型 – 基因型” 一体化的耐药性检测体系。
随着 MEMS 加工技术、微纳制造工艺的不断进步,以及 PDMS 芯片、类器官芯片等核心组件的性能优化,液滴微流控技术将在抗生素耐药性防控中发挥越来越重要的作用,为应对全球公共卫生危机提供强有力的技术支撑。
参考文献:https://doi.org/10.1021/acs.accounts.1c00729
© 2026. All Rights Reserved. 苏ICP备2022036544号-1













