1. 研究背景:癌症免疫治疗的瓶颈与微流控技术的崛起
癌症免疫治疗已成为对抗恶性肿瘤的核心方向之一,其中免疫检查点抑制剂(ICIs)通过解除 T 细胞免疫抑制,为部分患者带来了长期生存获益。然而,实体肿瘤患者对 ICIs 的响应率仅在 10% 至 40% 之间,核心瓶颈在于肿瘤基质形成的物理屏障与免疫抑制微环境,导致肿瘤浸润淋巴细胞(TIL)难以有效穿透肿瘤组织并发挥细胞毒性作用。
传统的药物筛选方法存在显著局限:2D 细胞培养无法复刻肿瘤的 3D 结构、基质屏障及缺氧核心等关键生理特征;动物模型则面临规模化差、耗时费力的问题,均难以精准评估 T 细胞浸润与杀伤的动态过程。在此背景下,微流控芯片技术凭借高通量、微型化、仿真性强的优势脱颖而出,结合 PDMS 材料的优良生物相容性与 MEMS 加工的精密制造能力,为构建贴近体内环境的肿瘤免疫模型提供了可能。3D 细胞培养芯片与器官芯片的出现,进一步实现了肿瘤组织与免疫细胞相互作用的实时追踪,成为突破免疫治疗筛选瓶颈的关键技术支撑。
2. 智能微流控筛选平台:设计原理与核心技术集成
1) 平台整体架构
研究团队开发的自动化高通量筛选系统,由微流控免疫 – 肿瘤相互作用平台与深度学习 TIL 评分分析仪两大核心模块组成,实现了从 3D 肿瘤培养、免疫细胞动态追踪到药物 efficacy 评估的全流程自动化。该平台通过 MEMS 加工技术制备的支柱晶格阵列,将 PDMS 芯片与标准微孔板结合,单次可生成 7680 个尺寸均一的 “核心 – 肿瘤壳 – 基质” 球体,解决了传统 3D 培养中球体融合、尺寸不均的技术痛点。
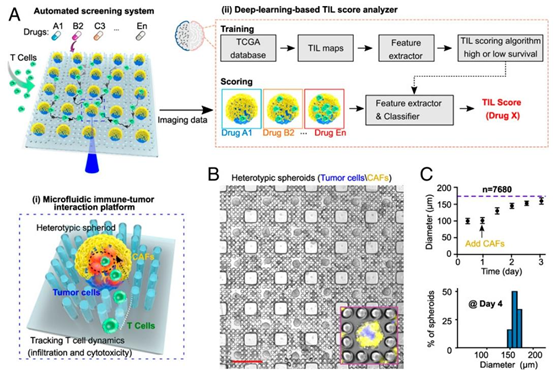
图1. 自动化筛选平台的整合。(A)癌症免疫疗法筛选自动化平台示意图,包括(i)用于高通量追踪T细胞动态行为的微流控免疫-肿瘤相互作用平台,以及(ii)基于深度学习的肿瘤浸润淋巴细胞(TIL)评分分析仪,用于图像处理和对与高生存率(\((>3 y)\))或低生存率患者群体图像中发现的TIL模式相对应的T细胞浸润模式进行评分。(B)核心/肿瘤壳/基质球体的可扩展微流控制造(肿瘤核心:蓝色,癌相关成纤维细胞(CAF);壳:黄色)。(C)柱状晶格阵列内的球体生长(箭头指示肿瘤核心形成后的CAF接种),以及球体形成第4天时肿瘤-基质球体的尺寸分布。(B中的比例尺:500μm。)
2) 核心技术亮点
PDMS 芯片与 MEMS 加工工艺:平台采用 PDMS 材料通过软光刻工艺制备,结合 MEMS 微纳加工技术实现支柱晶格阵列的高精度成型,保障了肿瘤球体的固定与免疫细胞的自由灌注。PDMS 芯片的透光性与生物相容性,为实时荧光成像追踪 T 细胞浸润提供了理想载体,而微流控芯片的微型化设计则大幅降低了试剂消耗与细胞用量。
3D 肿瘤 – 基质球体构建:通过两步细胞接种法,先形成肿瘤细胞核心,再包裹癌症相关成纤维细胞(CAFs)构建异质性球体,精准复刻了实体肿瘤的基质屏障与免疫抑制微环境。球体尺寸可通过肿瘤细胞与 CAFs 的接种比例灵活调控,最终稳定在 160±9.3μm,为高通量筛选提供了标准化模型。
深度学习 TIL 评分系统:基于 TCGA 数据库中 411 例黑色素瘤患者的病理图像与生存数据,训练深度学习算法构建 TIL 评分分析仪。该系统可自动提取 T 细胞浸润的数量、深度及聚类特征,生成与患者预后高度相关的综合评分,替代传统人工分析,实现了药物疗效评估的客观化与规模化。
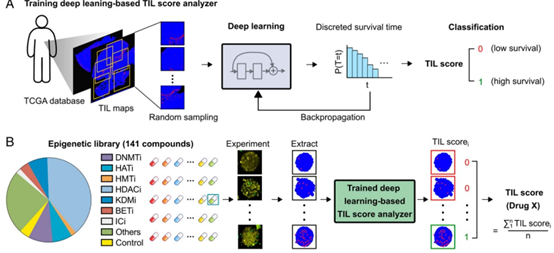
图3. 基于深度学习和临床数据的评分。(A) 使用TCGA数据库中411名患者的肿瘤H&E图像及相关患者生存信息训练基于深度学习的TIL评分分析器的示意图。(B) 示意图展示了141种小分子表观遗传调节剂库的筛选过程。我们的自动化系统追踪每种药物的T细胞肿瘤浸润图像,提取T细胞图谱,为每张图像分配TIL评分i(例如0、1),并通过对药物处理图像的多个TIL评分i取平均值,生成药物X的最终TIL评分。
3. 实验验证:从高通量筛选到体内疗效确认
1) 高通量药物筛选
研究团队利用该平台对 141 种表观遗传调节剂进行筛选,通过两步筛选策略:先排除细胞毒性大于 20% 的化合物,再对剩余非细胞毒性药物进行免疫活性评估。最终发现,赖氨酸特异性组蛋白去甲基化酶 1 抑制剂(GSK-LSD1)表现出最优的 TIL 浸润促进效果,其 TIL 评分为 0.6,显著高于 anti-PD1 单药治疗的 0.3 与空白对照的 0.1。
筛选过程中,微流控芯片的高通量优势得到充分体现,结合 PDMS 芯片的批量制备能力,实现了 96 种药物同时处理、12 小时实时追踪的高效筛选模式。MEMS 加工技术保障的芯片一致性,确保了筛选结果的可重复性,为后续药物验证奠定了坚实基础。
2) 体内外疗效验证
在体外实验中,GSK-LSD1 与 anti-PD1 联合治疗组的 T 细胞浸润深度、浸润数量及细胞毒性比例均显著高于单药组,证实了该组合在促进 T 细胞穿透肿瘤基质并杀伤肿瘤细胞的协同作用。体内 B16F10 小鼠模型进一步验证,联合治疗组的肿瘤生长抑制率显著提升,8 只小鼠中有 2 只实现肿瘤完全消退,肿瘤组织中 CD8+ T 细胞浸润数量较对照组增加 3 倍以上。
实验过程中,器官芯片技术的仿真性优势得到凸显,3D 肿瘤 – 基质球体模型预测的药物疗效与体内实验高度吻合,表明该微流控平台具备强大的临床转化潜力。而 PDMS 芯片的可定制化特性,使得该模型可灵活适配不同肿瘤类型,为个性化免疫治疗筛选提供了可能。
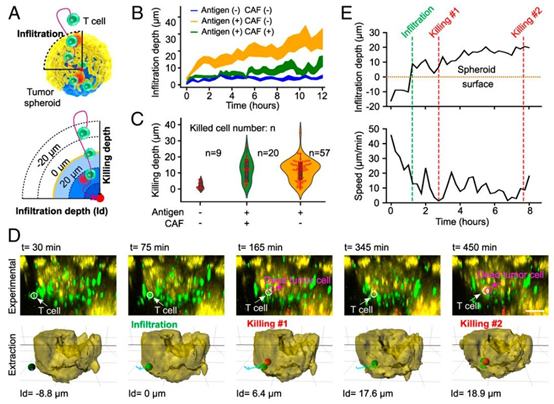
图2. T细胞肿瘤浸润和细胞毒性的追踪动态。(A)T细胞与肿瘤-基质球体之间动态相互作用的示意图。T细胞浸润深度定义为细胞到球体表面的径向距离,一旦T细胞浸润到球体内(或在球体外),浸润(或杀伤)深度为正(或负)。(B)T细胞浸润对肿瘤核心抗原呈递(抗原(+))和基质/CAF外壳存在(CAF(+))的依赖性。所有线条均带有68%置信区间(CI)。(C)T细胞杀伤深度和能力(n:被杀伤细胞数量)对肿瘤核心抗原呈递(抗原(+))和基质/CAF外壳(CAF(+))的依赖性。(D)肿瘤-基质球体内单个T细胞同时浸润和杀伤动态的延时图像及其提取(来自补充视频S1)。白色(或品红色)箭头和圆圈指示T细胞(或死亡的肿瘤细胞),浸润深度(Id)的负值表示球体外部的T细胞,正值表示球体内部的T细胞。(E)同一T细胞(在D中)随时间的浸润深度和速度的量化。绿色和红色虚线指示该T细胞的浸润和杀伤事件。(D中的比例尺:50μm。)
3) T 细胞动态行为解析
通过时间序列荧光成像,平台成功捕捉到 T 细胞的动态浸润与杀伤过程:T 细胞以高速趋化至肿瘤球体表面,缓慢穿透基质屏障后杀伤肿瘤细胞,随后加速迁移寻找下一个靶点。这一发现揭示了 T 细胞浸润的关键动力学特征,为设计针对性的免疫增强策略提供了新的理论依据。微流控芯片的高分辨率成像能力,使得单细胞水平的动态追踪成为可能,弥补了传统方法无法量化免疫细胞行为的缺陷。
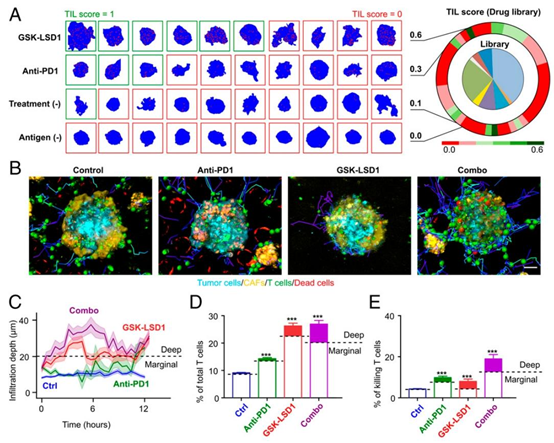
图4. 深度学习引导的表观遗传药物库筛选。(A)该药物库的筛选结果。热图显示了对照条件和药物条件下的肿瘤浸润淋巴细胞(TIL)评分。不同药物处理下,球体(蓝色背景)内T细胞(红点)分布的代表性图像。(B)从四种处理条件(未处理对照、抗PD1、GSK-LSD1和联合处理[combo])下,异型肿瘤球体中T细胞浸润和细胞毒性的延时图像中提取的细胞位置和轨迹(来自补充视频S2)。(C)四种处理条件下T细胞浸润深度随时间的变化。所有曲线均以68%置信区间(CI)绘制。(D)浸润T细胞占总T细胞的平均百分比。位于肿瘤球体深处的T细胞(浸润\(depth >20 \mu m\))被视为深度浸润T细胞,并用实心颜色标示。(E)杀伤性T细胞占总T细胞群的平均百分比。位于肿瘤球体深处的杀伤事件用实心颜色标示。统计分析:方差分析(ANOVA)。(B中的比例尺,30 μm。)
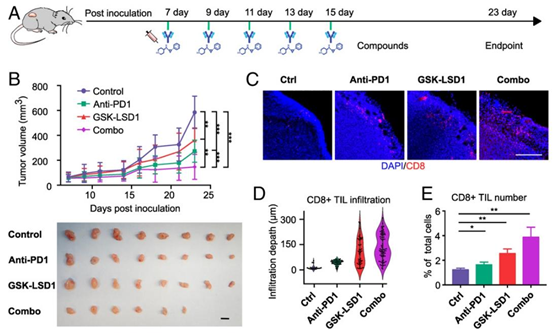
图5. 体内验证。(A)肿瘤接种和治疗时间线。在第7、9、11、13和15天腹腔注射抗PD1和GSK-LSD1。所有动物在第24天被实施安乐死以获取肿瘤。(B)四个治疗组动物的肿瘤生长曲线和最终大小。(比例尺,10毫米。)(C)四个治疗组肿瘤切片中浸润的\(CD8+\) T细胞的代表性图像。(比例尺,200微米。)(D)肿瘤切片中T细胞浸润深度分布(\((n=5)\)。(E)通过流式细胞术分析的所有肿瘤细胞中\(CD8+\) T细胞的百分比(\((n=3)\)。
4. 行业影响与未来展望:微纳加工技术的跨领域应用
1) 技术突破的行业价值
该研究首次实现了深度学习与微流控芯片技术的深度融合,构建了首个同时评估 T 细胞浸润与细胞毒性的高通量筛选平台。其核心创新在于将临床预后数据与体外筛选模型相结合,通过 TIL 评分系统直接关联药物疗效与患者生存,大幅提升了药物筛选的临床转化效率。PDMS 芯片制备与 MEMS 加工技术的成熟应用,为该平台的规模化生产与商业化推广提供了技术保障,有望替代传统筛选模型成为免疫治疗药物研发的标准工具。
2) 多领域应用拓展
除癌症免疫治疗外,该技术平台可广泛应用于自身免疫性疾病、神经炎症、再生医学等领域。在肿瘤类器官芯片开发中,结合微纳加工技术可构建更复杂的多器官芯片模型,模拟肿瘤转移过程中的免疫相互作用;在抗感染研究中,可用于评估免疫细胞对病原体的浸润与清除效率。MEMS 代工与微流控芯片定制服务的发展,将进一步降低该技术的应用门槛,推动基础研究与临床转化的快速对接。
3) 未来发展方向
未来,该平台将进一步优化芯片设计,整合微流控浓度梯度生成、单细胞分选等功能,实现更复杂的免疫微环境模拟;深度学习算法将纳入更多肿瘤类型的临床数据,提升药物筛选的特异性与广谱性。随着 PDMS 芯片加工工艺的不断升级与器官芯片加工平台的完善,有望构建 “从临床样本到个性化药物” 的全链条筛选体系,为精准免疫治疗提供一站式解决方案。
微流控芯片技术与深度学习的跨界融合,不仅突破了癌症免疫治疗筛选的技术瓶颈,更推动了微纳加工、3D 细胞培养、人工智能等多领域技术的协同创新。该研究为免疫治疗药物研发提供了全新范式,随着技术的不断成熟与推广,将为更多实体肿瘤患者带来新的治疗希望,引领癌症治疗进入精准免疫筛选的新时代。
参考文献:https://doi.org/10.1073/pnas.2214569119
© 2026. All Rights Reserved. 苏ICP备2022036544号-1













