1. 引言:抗生素耐药性危机与微流控技术的革新
抗生素的过度使用已引发全球范围内的细菌耐药性危机,成为威胁公共健康的重大挑战。传统抗菌策略因药物递送精准度不足、副作用明显等问题,难以满足临床抗感染治疗的需求。在此背景下,微流控技术凭借其精密操控流体的特性,为新型药物递送系统的开发提供了核心支撑。结合 MEMS 加工、PDMS 芯片制备等先进工艺,研究者成功构建出具有环境响应能力的智能递送平台,为解决抗生素耐药性难题开辟了新路径。本文聚焦青岛大学与南开大学联合研发的 AgNPs 负载 HTCC/HA 多孔微球(HHPMs),深入解读其制备原理、性能优势及临床应用价值,展现微流控技术在智能医药领域的核心竞争力。
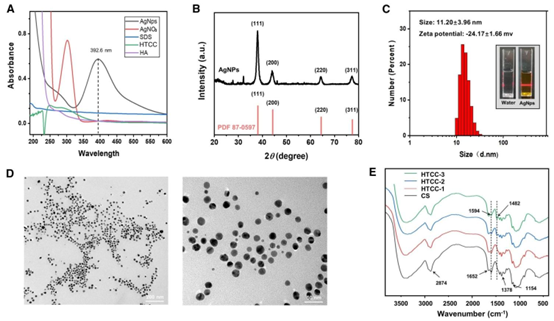
图1 AgNPs和HTCC的合成与表征。(A)AgNPs及所用其他组分的紫外-可见吸收光谱。(B)AgNPs的X射线衍射(XRD)图谱及标准对照信息。(C)AgNPs的粒径分布和丁达尔效应。(D)AgNPs的透射电子显微镜(TEM)图像。(E)壳聚糖(CS)和合成的HTCC的傅里叶变换红外(FTIR)光谱。JCPDS是粉末衍射标准联合委员会的缩写。
2. 微流控介导的 HHPMs 制备:材料设计与工艺创新
1) 核心材料的协同设计
HHPMs 的成功构建源于材料体系的精准搭配。研究者选用季铵化壳聚糖衍生物(HTCC)与透明质酸(HA)作为基础基质,HTCC 继承了壳聚糖的优良生物相容性,同时增强了抗菌活性与电正性;HA 作为细胞外基质的主要成分,具备生物安全性与生物降解性。二者通过氨基与羧基的静电相互作用自组装形成共聚物基质,为微球的 pH 响应特性奠定基础。负载的银纳米颗粒(AgNPs)作为经典抗菌剂,经液相化学还原法合成,粒径均一(约 10nm),具有稳定的表面等离子共振特性,确保抗菌效能的充分发挥。
2) 微流控工艺的精准调控
基于同轴毛细管玻璃管的微流控芯片装置,是实现 HHPMs 可控制备的关键。通过调节水相(HTCC、PAA、HA 与乙酸混合液)与油相(二氯甲烷与正辛烷混合液)的流速(优化后分别为 400mL/h 与 2800mL/h),可精准调控微球粒径(平均 146.2μm)。在凝固浴中,乙酸的扩散引发 pH 梯度变化,触发 HTCC 与 HA 的静电自组装,同时戊二醛(GLA)通过席夫碱反应与 HTCC 的氨基交联,形成稳定框架。冷冻干燥过程中水分流失进一步扩大孔隙,最终形成高比表面积的多孔结构 —— 这一工艺充分结合了 PDMS 芯片加工平台的精密控制与 MEMS 加工的微纳制造优势,确保微球尺寸均一性与结构稳定性。
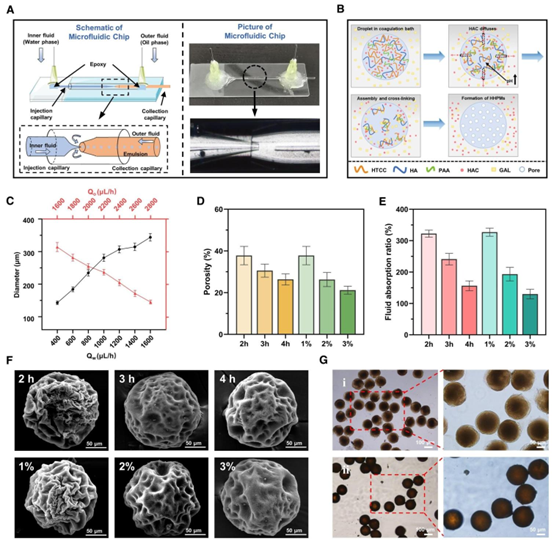
图2 HHPMs的微流控构建与表征。(A)HHPMs的微流控制备示意图。(B)HHPMs的形成与凝固机制示意图。(C)两相流速对所制备HHPMs尺寸的影响。(D)不同交联度HHPMs的实测孔隙率。HHPMs分别在1%–3% GLA中凝固2小时,以及在1% GLA中凝固2–4小时。(E)不同交联度下的流体吸收率。(F)不同交联度HHPMs的扫描电镜图像。HHPMs的制备方法如上所述。(G)HHPMs的光学显微镜图像(i)冷冻干燥前和(ii)冷冻干燥后
3) 制备参数的优化策略
为提升 HHPMs 的细菌捕获与药物释放能力,研究者对关键制备参数进行了系统优化。凝固时间与 GLA 浓度直接影响微球孔隙率:当 GLA 浓度为 1%、凝固时间为 2h 时,孔隙率可达 37.81%,流体吸附率高达 322.54%,为细菌捕获提供了充足空间;若参数过量(如 3% GLA、4h 凝固),则会因交联过度导致微球致密化,孔隙率降至 21.22% 以下,显著降低吸附效能。此外,HTCC 的季铵化程度需严格控制,过度季铵化(如 HTCC-3)会导致微球结构不稳定,最终选择 HTCC-2 作为最优原料,平衡抗菌活性与结构稳定性。
3. IME 响应特性与协同抗菌机制:性能核心优势
1) 细菌感染微环境的精准响应
HHPMs 的核心优势在于对细菌感染微环境(IME)的特异性响应。细菌感染部位会形成 pH 5.5-6.5 的酸性环境,且细菌分泌的透明质酸酶(HAase)浓度显著升高 —— 这两种特征成为微球触发药物释放的 “信号开关”。在酸性条件下,HTCC 与 GLA 的交联作用减弱,共聚物基质结构松散;HAase 则特异性降解 HA 组分,破坏基质完整性,二者协同加速 AgNPs 释放。实验数据显示,在 pH 5.5+1μg/mL HAase 的 IME 模拟环境中,48h 内 AgNPs 累积释放率达 54.22%,远高于中性环境的 28.95%,实现了 “感染部位精准释药” 的设计目标。
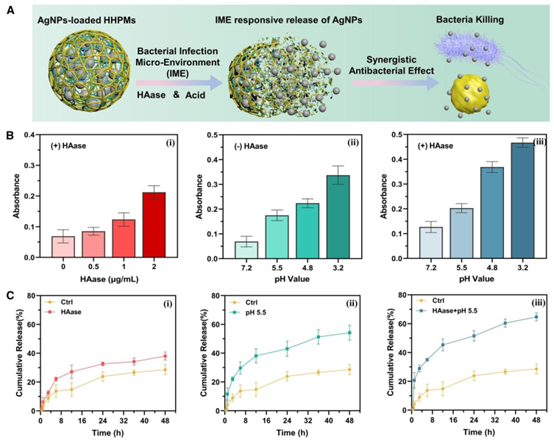
图3 负载AgNPs的HHPMs的IME响应性释放。(A)HHPMs在酸性pH值和透明质酸酶(HAase)作用下的IME响应性释放示意图。(B)在不同释放介质中释放的AgNPs的紫外-可见吸光度,包括不同的HAase浓度(分别为0、0.5、1和2 μg/mL)和pH值(分别为pH 3.2、4.8、5.5和7.2)。(C)在不同pH值的释放介质中,有无HAase时,HHPMs中AgNPs的累积释放量。
2) 多孔结构介导的细菌捕获与协同抗菌
HHPMs 的多孔结构不仅提升了药物负载容量(AgNPs 封装效率 67.66%),更实现了细菌的高效捕获与富集。高比表面积与 HTCC 的电正性共同作用,使微球能快速吸附带负电的细菌(如金黄色葡萄球菌、大肠杆菌),提高局部细菌浓度,增强 AgNPs 与细菌的接触概率。同时,HTCC 可直接破坏细菌细胞壁与生物膜,为 AgNPs 进入细菌内部发挥作用创造条件。体外抗菌实验表明,AgNPs 负载 HHPMs 对金黄色葡萄球菌的 MIC 仅为 3.12μg/mL,MBC 为 6.25μg/mL,显著低于游离 AgNPs(MIC 25μg/mL、MBC 50μg/mL),展现出 “捕获 – 释药 – 直接抗菌” 的协同效应。
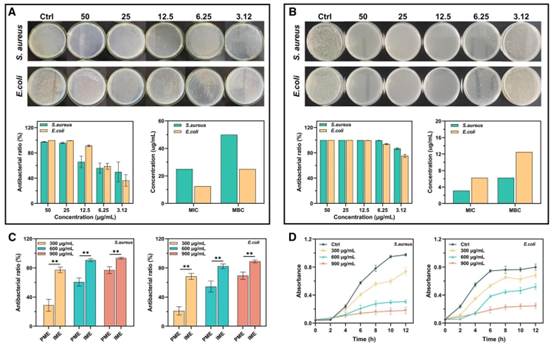
图4 银纳米颗粒(AgNPs)和载银纳米颗粒的HHPMs对金黄色葡萄球菌和大肠杆菌的抗菌效果。(A)银纳米颗粒和(B)载银纳米颗粒的HHPMs的最小抑菌浓度(MIC)和最小杀菌浓度(MBC)分析结果。(B)中提到的浓度是通过HHPMs的载药效率换算得到的银纳米颗粒相对浓度。(C)在生理微环境(PME)和感染微环境(IME)中,300、600和900 μg/mL的载银纳米颗粒的HHPMs的抗菌率。(**\((^{* *} p<0.01)\)。(D)载银纳米颗粒的HHPMs在LB液体培养基中对金黄色葡萄球菌和\(E.\)大肠杆菌生长的抑制作用。
3) 广谱抗菌活性的体外验证
研究者通过 MIC/MBC 测定、菌落计数、细菌死活染色等多种方法,验证了 HHPMs 的广谱抗菌性能。在 IME 模拟环境中,600μg/mL 的 HHPMs 对金黄色葡萄球菌的抗菌率达 90.62%,对大肠杆菌达 82.29%,均显著高于生理微环境(PME)中的抗菌效果(分别为 60.65%、54.36%)。扫描电镜与透射电镜观察显示,经 HHPMs 处理后,细菌出现细胞壁破裂、胞内物质泄漏等明显损伤,金黄色葡萄球菌甚至被分解为碎片结构,直观证实了其强效杀菌作用。
4. 体内外验证:生物相容性与临床转化潜力
1) 优异的生物安全性保障
临床应用的前提是良好的生物相容性。HHPMs 的生物安全性通过细胞毒性与溶血率两项核心指标验证:对 L929 小鼠成纤维细胞的实验显示,即使 AgNPs 相对浓度高达 70μg/mL,细胞存活率仍超过 70%,远高于游离 AgNPs 的细胞毒性(IC50 31.95μg/mL);所有浓度组的溶血率均低于 5% 的安全标准,表明其血液相容性良好。细胞死活染色实验中,绿色荧光(活细胞)占主导地位,进一步证实 HHPMs 对正常细胞的低毒性,为体内应用奠定基础。
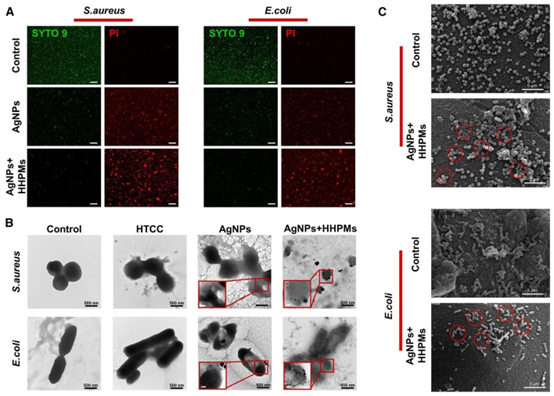
图5 不同样品处理前后细菌的状态和微观形态观察。(A) 细菌活/死荧光染色图像。比例尺为50 μm。(B) 未处理和经HHPMs处理2小时的细菌扫描电镜(SEM)图像。(C) 未处理以及经HTCC(50 μg/mL)、AgNPs(6 μg/mL)和预处理HHPMs(负载AgNPs的HHPMs 600 μg/mL与IME孵育12小时)处理的细菌透射电镜(TEM)图像。插图比例尺为200 nm。
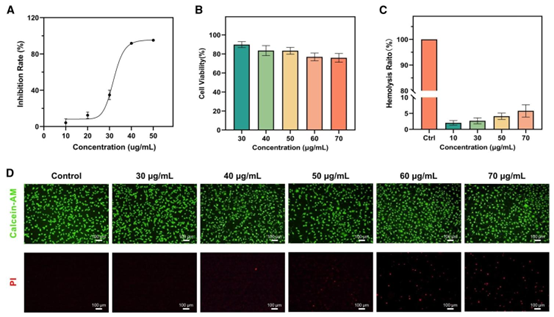
图6 AgNPs和HHPMs的生物相容性。(A)AgNPs的抑制率与浓度的关系。(B)不同浓度载AgNPs的HHPMs处理后L929细胞的存活率。(C)载AgNPs的HHPMs的溶血评估。(D)载AgNPs的HHPMs处理的L929细胞的钙黄绿素-AM/碘化丙啶(Calcein-AM/PI)染色。(B-D)中提到的浓度是指通过HHPMs的载药效率换算得到的AgNPs相对浓度。
2) 体内抗感染与伤口愈合的显著效能
在大鼠背部金黄色葡萄球菌感染伤口模型中,HHPMs 展现出卓越的体内治疗效果。与 PBS 对照组相比,AgNPs 负载 HHPMs 处理组的伤口愈合速率显著提升:治疗第 2 天愈合率达 26.01%,远高于 PBS 组的 8.53%;第 8 天时,伤口基本愈合,细菌存活率降至 25.06%,而 PBS 组仍存在严重炎症与脓肿。实验过程中大鼠体重保持稳定,未出现明显不良反应,证实 HHPMs 能在有效抑制细菌感染的同时,促进伤口组织再生,实现 “抗感染 – 愈合” 双重功效。
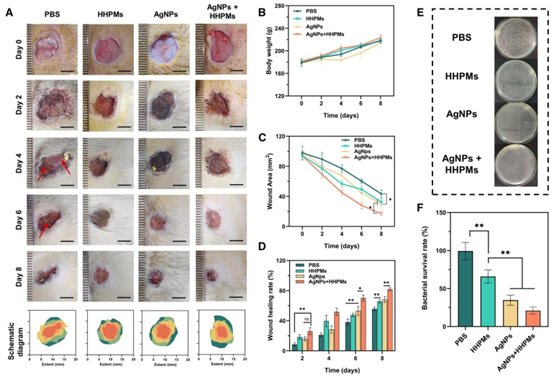
图7 体内抗菌能力和细菌感染伤口愈合的评估。(A)不同组在第0、2、4、6和8天的伤口代表性照片和示意图。比例尺:5毫米。(B)不同组在治疗过程中的体重。(C)不同组在治疗过程中的伤口面积。(D)不同组之间伤口愈合率的比较(*\(^{*} p<0.05\),\(^{* *} p<0.01\))。(E)从不同组处理的感染组织中获得的细菌菌落。(F)不同组处理的感染组织的相应细菌存活率(*\(^{*} p<0.05\),\(^{* *} p<0.01\))
3) 与器官芯片技术的协同发展潜力
HHPMs 的研发与应用,与器官芯片、3D 细胞培养芯片等前沿技术形成协同效应。在类器官芯片平台中,HHPMs 可作为精准抗菌模块,模拟体内感染微环境下的药物释放与抗菌过程,为抗感染药物的高通量筛选提供支撑;结合微流控细胞培养芯片的动态培养特性,可进一步优化 HHPMs 的材料配比与结构设计,提升其临床适配性。这种 “递送系统 – 芯片平台” 的结合模式,为智能医药的产业化发展提供了新范式。
5. 结语:微流控药物递送系统的行业发展方向
AgNPs 负载 HHPMs 的成功研发,充分展现了微流控技术在智能药物递送领域的核心优势。通过 MEMS 加工、PDMS 芯片制备等工艺的精准调控,实现了微球结构与响应性能的优化;依托细菌感染微环境的特异性信号,达成了抗菌药物的靶向释放与协同杀菌,为解决抗生素耐药性问题提供了切实可行的方案。未来,随着微流控芯片定制、器官芯片加工等技术的不断成熟,此类智能递送系统有望在皮肤感染、黏膜感染等多种临床场景中实现转化应用。
在产业化进程中,需进一步优化大规模制备工艺,降低生产成本,同时结合表面修饰、光刻胶模具改进等技术,提升微球的稳定性与靶向精度。相信随着材料科学与微流控技术的深度融合,更多具备环境响应能力的智能药物递送系统将不断涌现,为抗感染治疗乃至整个医药行业带来革命性变革。
参考文献:DOI: 10.1002/SMMD.20220012
© 2026. All Rights Reserved. 苏ICP备2022036544号-1













