1. 引言:COVID-19 检测需求与技术瓶颈
COVID-19 疫情的全球蔓延,对病毒检测技术的灵敏度、速度和便捷性提出了极高要求。传统检测方法中,RT-PCR 虽为金标准,但存在检测周期长(3-4 小时)、操作复杂的局限; lateral flow assay(LFA)试纸和酶联免疫吸附试验(ELISA)虽实现了快速或便捷检测,却因检测限偏高(分别为 341 PFU/mL 和 79.3 PFU/mL),易导致早期感染或无症状患者出现假阴性结果。在此背景下,融合表面增强拉曼散射(SERS)技术与微流控芯片的创新方案应运而生,通过 MEMS 加工工艺与 PDMS 芯片制备技术的深度整合,为 SARS-CoV-2 检测提供了兼具高灵敏度、高重复性和快速响应的解决方案。
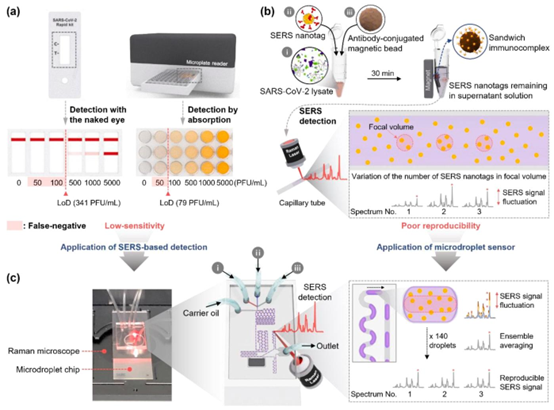
(a)使用96孔板的LFA试纸条和ELISA,(b)微管中基于磁珠的SERS检测平台,以及(c)用于SARS-CoV-2免疫诊断测试的微滴SERS传感器。在微管中的SERS检测中,将上清液转移到毛细管后,对聚焦体积内SERS纳米标签的拉曼信号进行测量。聚焦体积中存在的颗粒数量会沿测量区域发生变化。因此,由于信号强度波动,重现性会降低。在微滴传感器中,由于对连续通过激光聚焦体积的140个液滴中所含SERS纳米标签的拉曼信号进行测量,借助集合平均效应,重现性得到显著提高。
2. 核心技术原理:SERS 与微流控芯片的协同创新
1) 技术架构设计
该检测系统以微流控芯片为核心载体,采用 PDMS 材料通过光刻胶模具制备工艺打造微通道结构,芯片内部集成 droplet 生成、混合、分离与光学检测四大功能区。检测过程中,SARS-CoV-2 病毒经裂解液处理后释放核衣壳蛋白(N 蛋白),与捕获抗体修饰的磁珠、检测抗体偶联的 SERS 纳米标签形成三明治免疫复合物。借助芯片内嵌的磁条实现免疫复合物与上清液的快速分离,上清液中的 SERS 纳米标签随载体油形成均匀微滴,通过激光聚焦区域完成信号采集。
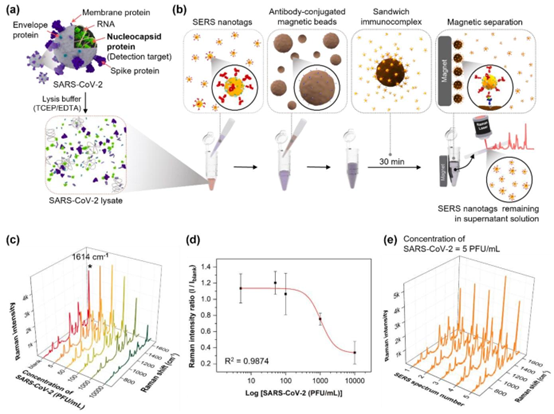
基于SERS的微管中磁珠检测SARS-CoV-2的方法。(a) 使用TCEP/EDTA溶液裂解SARS-CoV-2。(b) 在微管中使用SERS纳米标签和磁珠进行基于SERS的SARS-CoV-2免疫测定过程。(c) 在0–10,000 PFU/mL的SARS-CoV-2浓度范围内测量的毛细管中上清液的SERS光谱。(d) 使用四参数 sigmoidal 拟合方程确定的SARS-CoV-2免疫测定的校准曲线。(e) 在微管中对5 PFU/mL浓度的SARS-CoV-2进行基于磁珠的SERS测定后,在毛细管的五个不同位置测量的上清液的SERS光谱。
2) 关键技术支撑
SERS 纳米标签优化:采用中空金纳米球(HGNs)作为基底,表面修饰拉曼报告分子(MGITC)与 PEG 链,通过表面修饰技术提升纳米标签在复杂溶液中的稳定性,避免高盐或极端 pH 环境下的聚集与信号衰减。
微流控芯片加工:通过 MEMS 加工平台的光刻工艺制备 SU8 模具,结合 PDMS 浇筑与等离子键合技术,实现微通道(主通道宽度 200μm,深度 128μm)的精准成型,确保 droplet 生成与传输的稳定性。
信号增强机制:利用局域表面等离子体共振效应放大拉曼信号,同时通过 140 个微滴的 ensemble average 效应,降低单次检测的信号波动,提升数据可靠性。
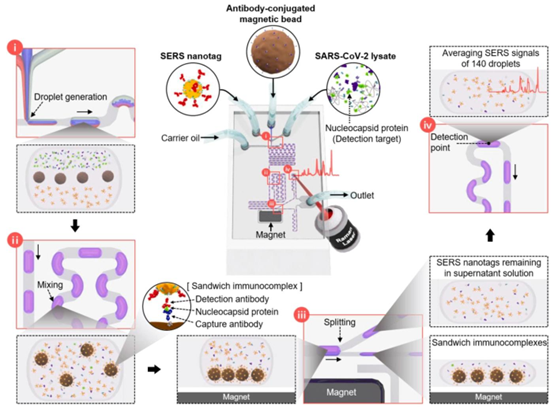
用于检测SARS-CoV-2的微滴通道示意图。该微流控通道由四个部分组成:(i)液滴生成、(ii)液滴混合、(iii)液滴分裂和(iv)光信号测量。
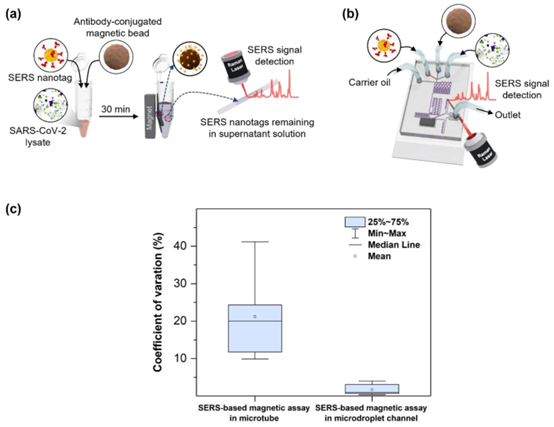
基于SERS的SARS-CoV-2检测方法在(a)微管和(b)微滴传感器中的比较。在使用微管的检测中,在毛细管的五个不同位置测量了SERS信号。在微滴传感器中,对140个通过焦体积的液滴的信号进行了测量并取平均值。(c)两种不同方法用于SARS-CoV-2检测的变异系数(CV)值比较。
3. 技术优势:灵敏度、重复性与效率的三重突破
1) 检测灵敏度跨越式提升
相较于传统方法,SERS 基微流控芯片的检测限(LoD)低至 0.22 PFU/mL,较微管中进行的 SERS 磁珠检测(36 PFU/mL)提升 160 余倍,远超 LFA 试纸和 ELISA 试剂盒。这一突破源于微滴分散带来的目标分子均匀分布,以及 SERS 技术对拉曼信号的高效放大,有效解决了低病毒载量样本的漏检问题。
2) 重复性与稳定性显著优化
通过微流控芯片的精准流体控制,检测过程的变异系数(CV)从微管检测的 21.2% 降至 1.79%。核心原因在于 PDMS 芯片的微通道结构通过 MEMS 加工工艺实现标准化生产,确保每个微滴的体积均匀性,同时 140 个微滴的信号平均效应抵消了单次测量的随机误差,为临床检测提供了可靠的数据支撑。
3) 检测效率与便捷性兼顾
借助微流控芯片的集成化设计,整个检测流程从样本处理到结果输出仅需 10 分钟,较微管 SERS 检测(30 分钟)和 ELISA(180 分钟)大幅缩短。芯片采用便携式拉曼光谱仪作为信号读取设备,配合 POC(point-of-care)诊断平台的设计理念,可满足现场快速检测需求,无需复杂实验室设备支持。
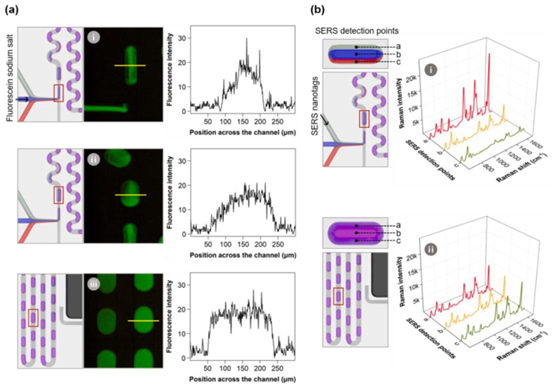
(a)荧光图像和(b)在微滴通道不同位置测量的单滴表面增强拉曼光谱,用于评估层流的混合效率。
4. 技术整合与工艺创新
1) 材料与工艺协同优化
芯片主体采用 PDMS 材料,通过 PDMS 键合对准平台实现芯片与玻璃基底的紧密贴合,确保微通道密封性的同时,保障光学检测的透光性。在 SERS 纳米标签制备中,通过 EDC/NHS 活化工艺实现抗体与纳米球的稳定偶联,结合 BSA 封闭技术降低非特异性结合,进一步提升检测特异性。
2) 流体控制与信号采集优化
通过调节 aqueous 相(0.8 μL/min)与油相(2.4 μL/min)的流速比,实现微滴大小与间距的精准控制,避免高流速下的 droplet 聚集或间距不规则问题。激光聚焦于微通道中心区域,对连续通过的 140 个微滴进行 15 秒信号采集,既保证了信号强度,又缩短了检测周期,实现了效率与灵敏度的平衡。
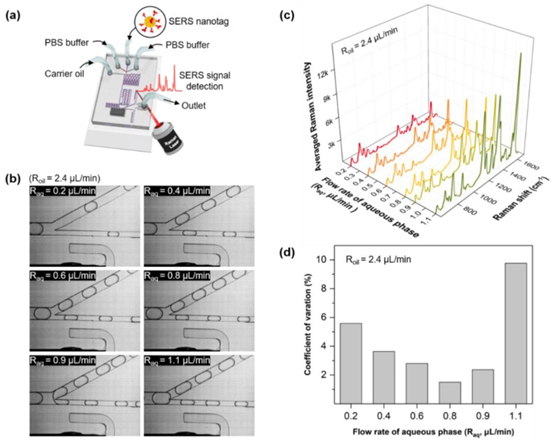
流速对SARS-CoV-2检测重现性的影响。(a) 将SERS纳米标签和PBS缓冲液引入入口,以建立驱动芯片的最佳条件。(b) 当每个液滴通过液滴分裂 junction时,六个不同的\(R_{aq} s\)的照片图像。(c) 在15秒内针对六种不同流速测量的SERS光谱。(d) 与(c)中SERs强度相对应的CV值随\(R_{aq}\)变化的变化情况。
5. 临床应用与行业拓展前景
1) 临床验证效果
针对 6 例临床鼻咽拭子样本(4 例阳性、2 例阴性)的检测结果显示,该系统与 RT-PCR 方法的一致性达 100%。阳性样本的拉曼信号强度比均低于 0.88(检测限阈值),阴性样本则均高于该阈值,证明其在临床样本检测中的可靠性,为疫情防控中的快速筛查提供了技术支撑。
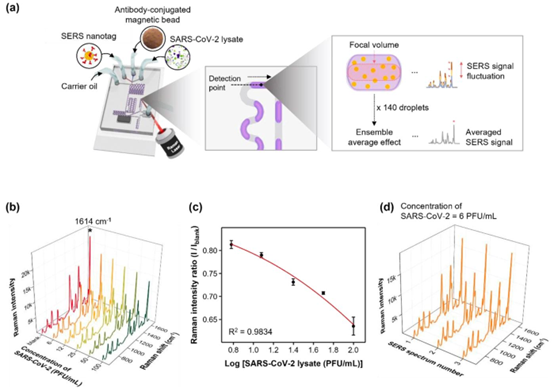
在微滴通道中对浓度为6 PFU/mL的SARS-CoV-2进行基于磁珠的SERS检测后,对含有上清液的液滴进行3次检测,每次15秒。对通过焦体积的140个液滴进行测量并取平均值,以提高其重现性。(b)六种不同浓度的SARS-CoV-2的芯片上检测SERS光谱。图5. 使用基于SERS的微滴传感器检测SARS-CoV-2裂解物。(a)用于检测SARS-CoV-2裂解物的基于SERS的微滴传感器。通过三参数 sigmoidal 拟合方程确定的SARS-CoV-2裂解物的浓度信号校准曲线。(d)测量的SERS光谱
2) 行业应用延伸
该技术方案通过更换抗体探针,可扩展至流感病毒、呼吸道合胞病毒等多种呼吸道病原体的检测,实现 “一芯片多检测”。借助微流控芯片的通道扩展与集成化设计,未来可与类器官芯片、3D 细胞培养芯片结合,构建集病毒检测、感染机制研究于一体的多功能平台。此外,PDMS 芯片的低成本制备(单芯片成本约 1.5 美元)与便携式检测系统的整合,使其在基层医疗、口岸检疫等场景具备广阔应用前景。
3) 技术升级方向
未来可通过微流控芯片的多通道设计实现高通量检测,结合数字微流控技术提升样本处理的自动化水平;同时优化 SERS 纳米标签的生物相容性与靶向性,探索与器官芯片的联合应用,为病毒感染的动态监测与药物筛选提供新工具。
基于 SERS 技术的微流控芯片检测系统,通过 MEMS 加工工艺、PDMS 芯片制备技术与 SERS 传感技术的创新融合,突破了传统 SARS-CoV-2 检测方法在灵敏度、重复性与检测速度上的三重瓶颈。其 0.22 PFU/mL 的检测限、10 分钟的检测周期与 1.79% 的变异系数,不仅满足了临床精准检测的需求,更通过 POC 设计理念实现了检测场景的灵活拓展。随着微流控芯片加工技术的不断成熟,以及表面修饰、纳米材料等配套技术的持续优化,该系统有望成为 infectious diseases 快速诊断的核心平台,为公共卫生应急响应提供强有力的技术支撑。
参考文献:https://doi.org/10.1016/j.cej.2022.137085
© 2026. All Rights Reserved. 苏ICP备2022036544号-1













