1. 引言
免疫治疗作为精准对抗癌症的核心手段,通过激活人体免疫系统的天然防御能力识别并清除癌细胞,凭借免疫记忆实现长期控瘤与复发预防,在血液系统恶性肿瘤和黑色素瘤治疗中取得了突破性成效。然而,实体瘤的免疫抑制性肿瘤微环境(TME)—— 包括缺氧环境、酸性 pH 值、营养匮乏、血管功能异常等复杂特征,成为免疫治疗的主要障碍。传统 2D 细胞单层培养和患者来源异种移植等动物模型,难以精准复刻人体 TME 的复杂性,导致临床转化价值有限,无法有效预测治疗效果。
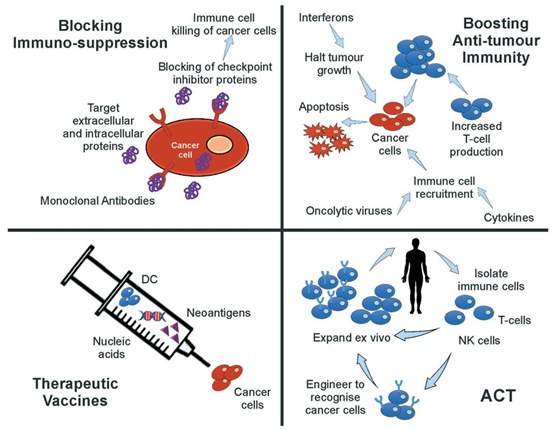
图1 免疫治疗策略。最常见的免疫治疗方法及其作用机制示意图(树突状细胞(DC)、过继性细胞转移(ACT))。
微流控技术(又称芯片实验室技术)的崛起为这一困境提供了创新解决方案。基于 PDMS(聚二甲基硅氧烷)、COP(环烯烃聚合物)、PMMA(聚甲基丙烯酸甲酯)等材料的微流控芯片,通过 MEMS 加工工艺实现微型化通道与培养腔室设计,结合 3D 细胞培养芯片技术,能够精准模拟实体瘤的生理微环境,同时具备样本消耗少、实验通量高、环境参数可控等优势。从芯片制备的光刻、深硅刻蚀、阳极键合等核心工艺,到表面修饰(如氨基修饰、PEG 修饰、环氧基修饰)提升细胞相容性,微流控技术正全面革新实体瘤免疫治疗的基础研究与临床转化路径,成为连接基础科研与临床应用的关键桥梁。
2. 实体瘤免疫治疗的主要策略与临床挑战
1) 核心免疫治疗技术路径
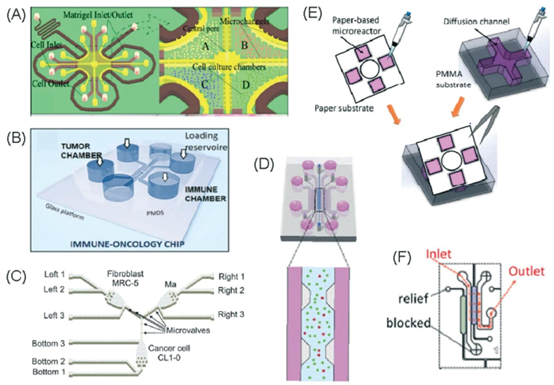
图2 用于研究癌症和免疫细胞迁移及相互作用的微流控分析。(A)经Liu等人许可改编,2015年,版权所有2015,《肿瘤靶点》。39(B)经Biselli等人许可改编,《科学报告》,2017年http://creativecommons.org/licenses/by/4.0/。(C)经Hsu等人许可改编,2012年,版权所有2012,《整合生物学》。33(D)经Boussommier-Calleja等人许可改编,2018年,版权所有2018,爱思唯尔。44(E)经Lei等人许可改编,2020年,版权所有2017,美国化学会。45(F)经Chen等人许可改编,2018年,版权所有2018,美国国家科学院。43
- 免疫检查点抑制剂(ICIs):作为目前最成功的免疫治疗类型,通过阻断 T 细胞表面 CTLA-4、PD-1 等共抑制分子与配体的结合,解除免疫抑制,释放 T 细胞杀伤活性。PD-1 抑制剂帕博利珠单抗、纳武利尤单抗已获批用于 25 种以上实体瘤治疗,但在黑色素瘤、肺癌中的响应率仍不足 40%,亟需更精准的预临床模型优化治疗方案。
- 过继性细胞转移(ACT):包括肿瘤浸润 T 细胞、CAR-T 细胞、NK 细胞等免疫细胞的体外分离、修饰与扩增,回输患者体内发挥杀伤作用。CAR-T 细胞在血液肿瘤中疗效显著,但实体瘤治疗面临肿瘤特异性抗原缺乏、TME 抑制细胞浸润等问题,而 NK 细胞通过细胞共培养芯片研究显示,其在 3D 环境中的细胞毒性与 2D 模型存在显著差异。
- 治疗性疫苗与溶瘤病毒:重组疫苗、树突状细胞疫苗(如 Sipuleucel-T)通过激活抗原呈递细胞增强 T 细胞响应,溶瘤病毒则选择性杀伤癌细胞并引发全身抗瘤免疫。但疫苗单药疗效有限,溶瘤病毒的肿瘤穿透性与重复治疗耐受性仍需通过微流控模型深入研究。
- 细胞因子疗法:干扰素、白介素等细胞因子可增强免疫细胞活性、诱导癌细胞凋亡,但半衰期短、高剂量易引发严重副作用,其递送效率与安全性需借助微流控芯片进行精准评估。
2) 临床转化的核心瓶颈
实体瘤的异质性、TME 的免疫抑制网络,以及传统模型无法模拟的细胞间动态相互作用,导致多数免疫治疗在临床阶段失败。例如,2D 培养中显示强效杀伤的 CAR-T 细胞,在 3D 细胞培养芯片中因肿瘤微环境屏障而难以浸润核心区域;免疫检查点抑制剂的疗效预测依赖于肿瘤组织 PD-L1 表达,但传统检测方法无法反映动态免疫应答过程。这些挑战推动了微流控技术在预临床研究中的广泛应用。
3. 微流控技术在实体瘤免疫治疗研究中的核心应用
1) 肿瘤 – 免疫细胞相互作用与迁移研究
微流控芯片通过精准设计的微通道网络,实现肿瘤细胞、免疫细胞、基质细胞的共培养,模拟细胞间化学信号传递与物理接触。基于 PDMS 的多通道芯片(如 Y 形通道、平行微通道设计)已用于研究巨噬细胞与肿瘤细胞的相互作用,揭示 ICAM-1 分子在肿瘤细胞解离与迁移中的关键作用。在细胞迁移研究中,微流控芯片可构建梯度化化学趋化环境,观察 PBMC(外周血单个核细胞)、NK 细胞向肿瘤细胞的迁移过程,而 FPR1 基因变异对迁移能力的影响,通过芯片实时成像技术得到精准验证。
此外,纸基 – PMMA 复合微流控芯片、 hydrogel 嵌入型芯片等新型平台,能够模拟肿瘤血管网络与 ECM(细胞外基质)屏障,研究中性粒细胞对肿瘤细胞外渗的促进作用,为抗转移免疫治疗提供新靶点。这些研究均依赖于微流控芯片定制加工的高精度,如微通道尺寸控制、细胞培养腔室的表面修饰优化(如亲水修饰、功能化载玻片结合)。
2) 免疫细胞介导的细胞毒性评估
ACT 疗法的疗效评估是微流控技术的核心应用场景。通过阻抗传感与光学散射集成芯片,可同时监测肿瘤细胞侵袭与免疫细胞杀伤动态,发现 2D 模型显著高估 T 细胞杀伤能力,而 3D 微流控模型中缺氧环境(2% O₂)会显著降低 T 细胞毒性。CAR-T 细胞的临床前评估中,含氧量梯度芯片揭示了 PD-L1 在缺氧条件下的高表达对 CAR-T 功能的抑制,为联合治疗提供依据。
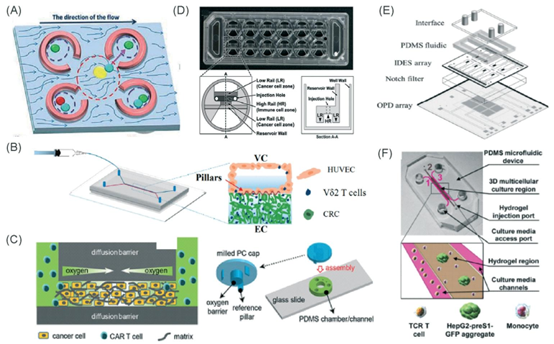
图3 免疫细胞介导的细胞毒性的微流控实例。(A)经Ke等人许可改编,2017年,版权所有2017年,《芯片实验室》。54(B)经Di Mascolo等人许可改编,2019年,版权所有2019年,《癌症》,http://creativecommons.org/licenses/by/4.0/;50(C)经Ando等人许可改编,2019年,版权所有2019年,《先进医疗材料》。52(D)经Park等人许可改编,2019年,版权所有2019年,《免疫学前沿》,http://creativecommons.org/licenses/by/4.0/。56(E)经Charwat等人许可改编,2013年,版权所有2013年,美国化学会。48(F)经Lee等人许可改编,2018年,版权所有2018年,《免疫学前沿》,http:// creativecommons.org/licenses/by/4.0/。55
NK 细胞的细胞毒性与抗体依赖的细胞毒性(ADCC)研究中,多腔室 PDMS 芯片模拟血管内皮屏障,观察到 NK 细胞可穿透 ECM 浸润肿瘤球核心,而抗体需通过内皮细胞外渗才能发挥作用。基于微流控的 3D 细胞毒性 assay 平台(如 CACI-IMPACT)已实现高通量筛选,为 NK 细胞疗法的优化提供技术支撑。
3) 免疫治疗机制与联合疗法研究
微流控芯片为免疫治疗机制研究提供了精准可控的体外模型。在免疫检查点 blockade(ICB)研究中,COP 塑料芯片因低药物吸附特性,更适合评估疏水性小分子与 ICB 的联合疗效,发现 PD-1+CTLA-4 双阻断在患者来源类器官模型中可显著增强 CD8+T 细胞浸润与巨噬细胞活化。
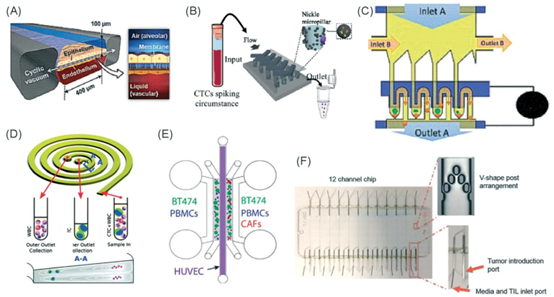
图4 用于肿瘤免疫(I/O)机制和作用方式研究的微流控技术示例。(A)经Huh等人许可改编,2018年,版权所有2018年,《科学转化医学》。69(B)经Yin等人许可改编,2018年,版权所有2018年,美国化学会。71(C)经Lu等人许可改编,2015年,版权所有2015年,《肿瘤靶点》,http://creativecommons.org/licenses/by/4.0/。65(D)经Warkiani等人许可改编,2014年,版权所有2014年,英国皇家化学会,http://creativecommons.org/licenses/by/4.0/。72(E)经Nguyen等人许可改编,2018年,版权所有2018年,英国皇家化学会,http://creativecommons.org/licenses/by/4.0/。70(F)经Moore等人许可改编,2018年,版权所有2018年,英国皇家化学会。63
治疗性疫苗的机制研究中,微流控细胞电融合芯片实现树突状细胞与肿瘤细胞的高效融合,融合效率达 64%,且细胞 viability 显著高于传统方法。在溶瘤病毒与细胞因子联合治疗研究中,微流控芯片模拟肿瘤纤维化基质屏障,评估病毒穿透效率与细胞因子释放的协同作用,为给药方案优化提供数据支持。
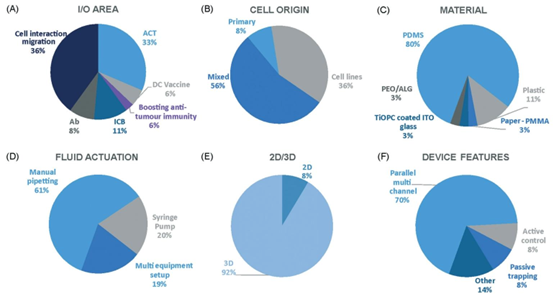
图5 用于实体瘤免疫疗法体外研究的微流控方法表征。饼图展示:(A)所实施的免疫检查点抑制剂区域或免疫疗法类型,(B)用于体外检测的细胞来源,(C)微流控装置的主体材料,(D)流体驱动类型,(E)细胞模型的空间排列,以及(F)表征或使微流控模型成为可能的装置特征。
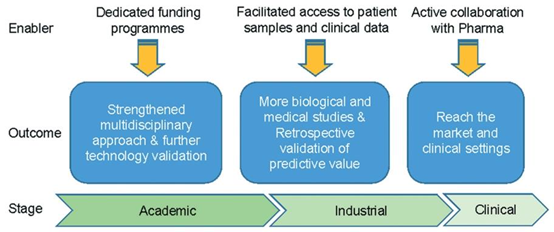
图6 成功路线图。验证用于免疫疗法开发的微流体技术的路径。
4. 微流控芯片关键制备与加工技术
1) 核心材料与加工工艺
微流控芯片的性能依赖于材料选择与加工精度。PDMS 因生物相容性、光学透明度与气体通透性,成为 80% 以上研究的首选材料,其制备过程涉及 PDMS 浇筑、光刻胶模具(如 SU8 模具)成型、PDMS 等离子键合等关键步骤。MEMS 加工技术(如电子束光刻、深硅刻蚀、阳极键合)用于制作高精度微通道与微反应器,而注塑成型工艺则支持聚苯乙烯、COP 等材料芯片的批量生产,满足高通量研究需求。
表面修饰技术是提升芯片性能的关键,包括醛基化修饰、氨基修饰、PEG 修饰等,可改善细胞黏附、减少非特异性结合。例如,环氧基官能化载玻片与 PDMS 芯片的结合,可增强 ECM 蛋白固定效率,模拟更真实的肿瘤微环境。此外,微流控芯片打孔器、对准平台等加工设备,确保了芯片装配的精度与密封性。
2) 芯片类型与功能拓展
根据应用场景,微流控芯片可分为细胞共培养芯片、浓度梯度芯片、器官芯片(如 liver-chip、brain-chip)等。3D 细胞培养芯片通过 hydrogel 嵌入、肿瘤球培养等方式,模拟实体瘤的空间结构;而多器官芯片(如血管 – 肿瘤 – 免疫器官集成芯片)则可评估免疫治疗的系统性效应。在个性化医疗中,患者活检组织微流控芯片可同时测试多种免疫疗法(如 ICB、CAR-T、疫苗),实现治疗方案的精准筛选。
微流控芯片的功能拓展还依赖于集成化设计,如将微流控与 PCR 技术结合的数字 PCR 芯片、整合传感器的实时监测芯片,以及与纳米技术结合的药物递送芯片(如叶酸修饰纳米颗粒靶向递送 chemokine)。这些创新均基于微纳加工平台的技术突破,如微流控与 MEMS 的集成、激光工程硅微模具的高精度制造。
5. 挑战与未来展望
1) 当前技术瓶颈
微流控技术的广泛应用仍面临多重挑战:材料方面,PDMS 的药物吸附特性限制了部分小分子药物研究,而玻璃、硅基芯片的加工成本较高;模型复杂度方面,现有芯片多模拟单一 TME 特征,难以复刻免疫系统与肿瘤的全身性相互作用;临床转化方面,芯片与临床数据的关联性需进一步验证,标准化流程(如芯片制备、实验操作)尚未建立。此外,微流控芯片的规模化生产(如批量光刻、自动化键合)与高通量集成,仍是工业界应用的关键障碍。
2) 未来发展方向
- 模型精准化与复杂化:开发多细胞类型、多器官集成的 “人体芯片”,整合免疫细胞、基质细胞、血管网络与神经内分泌系统,模拟实体瘤的系统性免疫应答。类器官微流控芯片将成为个性化医疗的核心工具,通过患者来源类器官与免疫细胞共培养,实现治疗方案的精准预测。
- 技术集成与自动化:结合 AI 与机器学习的微流控芯片,可实现细胞行为的自动分析与数据解读;自动化 perfusion 系统、机器人液体处理与芯片的集成,将提升实验通量与重复性,推动药物筛选应用。
- 材料创新与工艺优化:新型生物相容性材料(如非动物源 hydrogel、可降解聚合物)的开发,将降低芯片的生物安全性风险;MEMS 加工工艺的优化(如激光纳米加工、3D 打印模具)将降低芯片定制成本,实现规模化生产。
- 临床转化与监管认可:建立微流控芯片与临床终点的相关性数据库,推动监管机构对芯片预临床数据的认可;开发便携式微流控检测设备,实现免疫治疗疗效的实时监测(如循环肿瘤细胞 PD-L1 表达检测)。
微流控技术凭借其迷你化、精准化、高通量的优势,已成为实体瘤免疫治疗研究的革命性工具。从 PDMS 芯片的基础研究到器官芯片的临床转化,从细胞相互作用机制到联合疗法筛选,微流控技术正全方位突破传统模型的局限。随着 MEMS 加工、表面修饰、芯片定制等核心技术的不断优化,以及多学科交叉(如免疫生物学、材料科学、自动化技术)的深入,微流控芯片将在个性化免疫治疗、药物研发与临床决策中发挥核心作用,为实体瘤患者带来新的治疗希望。未来,通过学术界与工业界的协同创新,微流控技术将实现从实验室到临床的跨越,成为免疫治疗领域的核心支撑平台。
参考文献:DOI: 10.1039/d0lc01305f
顶旭微控定制产品
订购方式



© 2026. All Rights Reserved. 苏ICP备2022036544号-1












