1. 引言
微流控技术作为 Lab-on-a-chip(LOC)的核心支撑,已在生命科学、生物医药、环境监测等领域实现广泛应用,其核心优势在于能够在微尺度空间内精准操控流体与微粒,满足高通量、低消耗的分析需求。器官芯片、3D 细胞培养芯片等新型微流控器件的兴起,进一步推动了临床诊断、药物筛选等场景的技术革新。在众多微粒操控技术中,介电泳(DEP)凭借无标记、易集成、适配微尺度的特性,成为微流控芯片中细胞、纳米颗粒、生物分子操控的关键手段。本文基于 DEP 技术的核心原理,结合微流控芯片的加工工艺与实际应用,系统解读其技术逻辑与行业发展方向,为相关领域的研发与产业化提供参考。
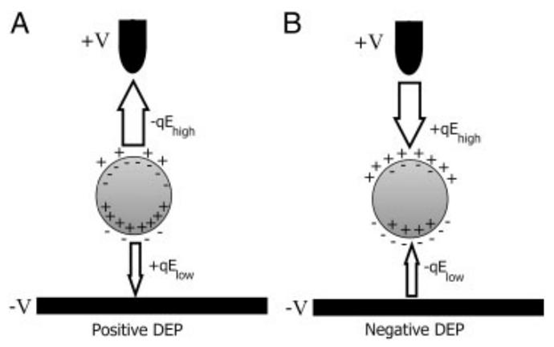
图1. 非均匀电场存在时感应偶极子上的介电泳力。(A) 正向介电泳;(B) 反向介电泳。
2. 介电泳(DEP)技术核心原理与分类
1) 基本原理
介电泳是指微粒在非均匀电场中,通过自身偶极子与电场空间梯度的相互作用产生定向运动的现象。微粒的偶极子包括固有偶极子和外电场诱导产生的诱导偶极子,其运动方向由微粒与悬浮介质的极化率差异决定:当微粒极化率高于介质时,微粒向电场强度最大值区域移动(正 DEP,p-DEP);反之则向电场最小值区域移动(负 DEP,n-DEP)。DEP 力的大小与微粒体积、电场强度梯度、 Clausius-Mossotti(CM)因子直接相关,这一特性使其能够根据微粒尺寸、电学性质实现精准分选与操控。
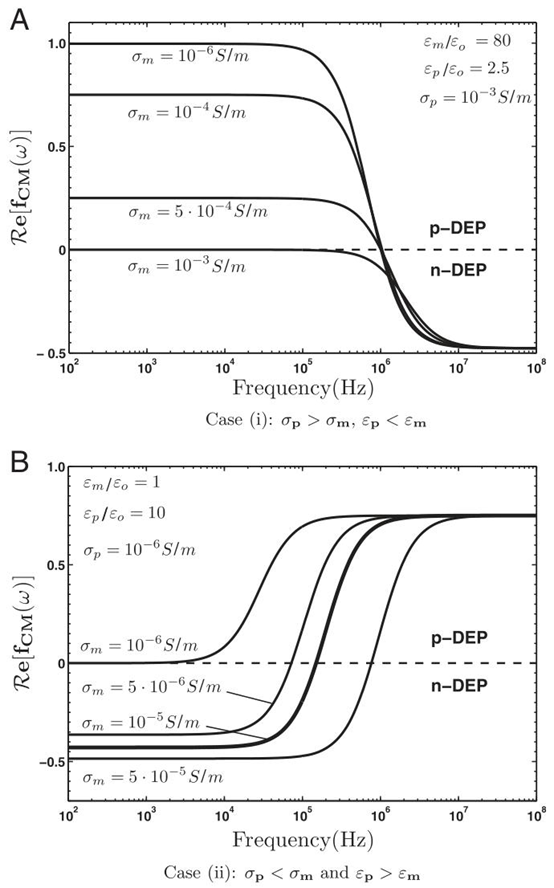
图2. 介电球体的DEP光谱。(A) 情况(i):\(\sigma_{p}>\sigma_{m}\) 和 \(\varepsilon_{p}<\varepsilon_{m}\)。(B) 情况(ii):\(\sigma_{p}<\sigma_{m}\) 和 \(\varepsilon_{p}>\varepsilon_{m}\)
2) 技术分类与特性
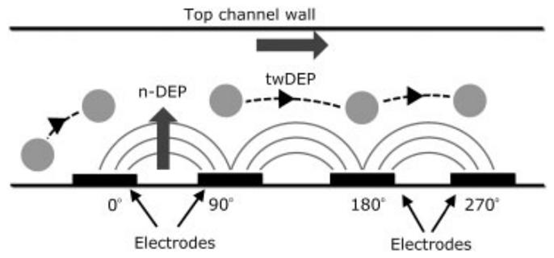
图3. 粒子的行波介电泳(twDEP)运动示意图。
根据驱动电场类型,DEP 技术主要分为直流介电泳(DC-DEP)和交流介电泳(AC-DEP)两类,二者在微流控芯片中的应用各有侧重:
- DC-DEP 通过外置电极施加直流电压,依托微通道内的绝缘障碍(如 PDMS 浇筑的微柱结构)产生非均匀电场,即绝缘体型介电泳(iDEP)。其优势在于芯片结构简单、无内置电极污染风险,但需高电压驱动,可能引发焦耳热与气泡生成,需通过 PDMS 芯片的良好散热特性与微通道优化设计缓解。
- AC-DEP 采用内置金属电极阵列,通过低频至高频交流电压产生电场,无需高电压即可避免焦耳热问题,适配生物样本(如活细胞)的长期操控。电极阵列的制备依赖 MEMS 微纳加工技术,包括紫外光刻、电子束蒸发等工艺,常用 SU8 光刻胶模具实现高精度电极图案化。
3. 微流控芯片加工关键技术与设备集成
DEP 技术的落地高度依赖微流控芯片的加工精度与功能适配性,核心加工环节与关键设备围绕 PDMS 芯片、MEMS 电极、表面修饰三大核心展开:
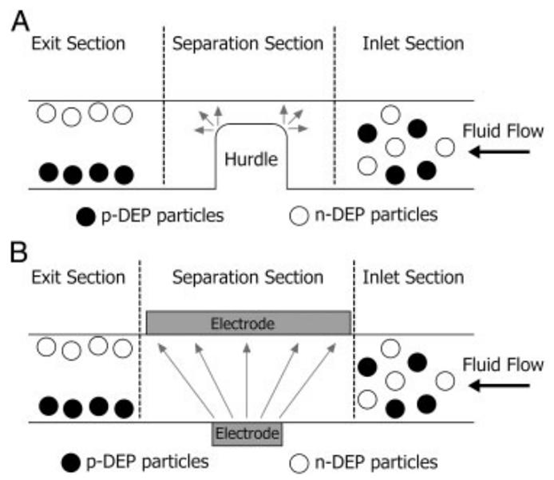
图7. 基于介电泳的微流控器件示意图:(A)通过绝缘障碍产生的非均匀电场,(B)通过不对称电极产生的非均匀电场(灰色箭头表示负介电泳力的方向)。
1) PDMS 芯片制备与成型
PDMS(聚二甲基硅氧烷)是微流控芯片的主流基材,其制备流程涵盖模具制作、浇筑、固化、键合等步骤。模具加工常用 SU8 光刻胶或纯硅模具,通过光刻机(如紫外掩膜光刻机)实现微通道、绝缘障碍等结构的精准复刻;PDMS 浇筑需使用专用浇筑器控制厚度均匀性,固化后通过 PDMS 键合机与玻璃或 PDMS 基板实现不可逆键合,键合过程中需借助对准平台保证微通道与电极的精准对位。此外,PDMS 芯片的功能扩展还涉及打孔器、热板、烘箱等辅助设备,形成从基材处理到成品检测的完整加工链。
2) MEMS 微纳加工与电极制备
AC-DEP 芯片的核心是内置电极阵列,其加工依赖 MEMS 微纳加工平台的全套技术。首先通过光刻工艺在硅片或玻璃基板上定义电极图案,使用电子束蒸发或化学气相沉积技术沉积金属层(如金、铂),再经刻蚀工艺形成所需电极结构(平面电极或 3D 侧壁电极)。对于高通量需求,可采用 MEMS 代工服务实现电极阵列的批量生产,结合深硅刻蚀技术制作 3D 电极,提升 DEP 力的空间覆盖范围。
3) 表面修饰与性能优化
为提升微流控芯片的生物相容性与操控稳定性,需对芯片表面进行功能化修饰。常用修饰方式包括亲水修饰、环氧基修饰、醛基化修饰等,通过 PEG 修饰、氨基修饰等技术降低细胞与通道壁的非特异性吸附,或通过醛基修饰载玻片实现生物分子的固定。表面修饰技术与 PDMS 芯片的加工工艺协同,可显著改善 DEP 操控的精准度与重复性,尤其适配生物样本(如血液细胞、细菌)的长期培养与分析。
4. DEP 在微流控芯片中的核心应用场景
1) 生物微粒分离与分选
DEP 技术凭借对微粒尺寸、电学性质的高敏感性,成为细胞、细菌、病毒分离的核心手段。在细胞培养芯片中,可通过 DC-DEP 的绝缘障碍结构实现不同尺寸肿瘤细胞与白细胞的分离,或利用 AC-DEP 的频率调控特性,基于细胞 dielectric 签名差异分选活细胞与死细胞。例如,在 3D 细胞培养芯片中,DEP 力可辅助干细胞在微通道内的精准定位,为类器官构建提供均匀的细胞初始分布;在器官芯片中,DEP 技术可实现血管内皮细胞的定向排列,模拟体内血管结构。

[4],(D)选择性捕集器(C)使用选择性捕集枯草芽孢杆菌[6],版权所有2008年施普林格),经参考文献[6]许可,三角形障碍(转载自参考文献[6],版权所有2008年(经许可转载)使用矩形障碍按大小分离白细胞图8.(A)分离枯草芽孢杆菌[4]。
2) 纳米颗粒与生物分子操控
对于碳纳米管、量子点、DNA 等纳米尺度物质,DEP 技术能够实现高效捕获、浓缩与图案化。在微流控芯片中,通过优化电极间距(如纳米级间隙)与电场频率,可对 200nm 以下的纳米颗粒进行精准操控,这一特性已应用于纳米药物递送系统的研发。此外,DEP 技术还可用于 DNA 分子的浓缩与分离,结合微流控芯片的微通道加工技术,实现核酸检测的高通量化与快速化。
3) 细胞图案化与组织工程
在组织工程领域,DEP 技术可驱动细胞在芯片表面形成特定图案,构建仿生组织模型。通过设计阵列化电极,利用 p-DEP 将细胞吸附至电极区域,形成均匀的细胞单层或多层结构,适配肝器官芯片、肺器官芯片等仿生器件的构建。PDMS 芯片的良好生物相容性与表面修饰技术(如胶原修饰)协同,可提升细胞图案的稳定性与功能性,为药物毒性检测、疾病模型构建提供可靠平台。
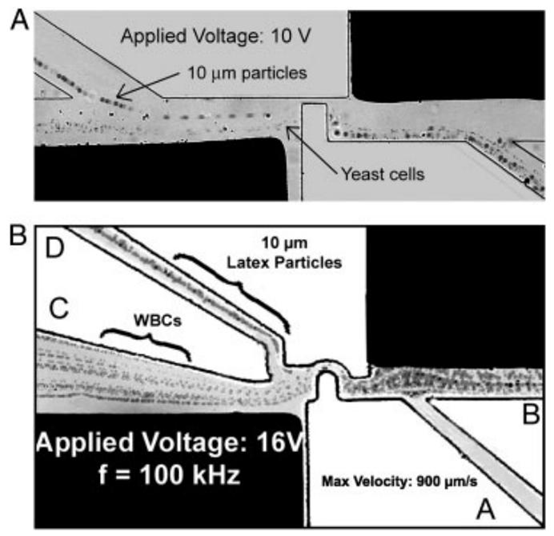
乳胶颗粒[67]。爱思唯尔),以及(B)白细胞分离和10毫米(经参考文献[64]许可转载,2009年版权所有 图9.(A)白细胞和酵母细胞的分离
5. 技术挑战与未来发展趋势
1) 现存技术瓶颈
当前 DEP 微流控技术面临三大核心挑战:一是通量限制,传统芯片通道宽度与电极覆盖范围有限,难以满足临床样本的高通量分析需求;二是设备集成度低,现有系统依赖复杂的外置电源与检测设备,不利于手持化、点 – of-care 检测的实现;三是高导电介质适配性差,生物样本(如血液)的高导电性易导致 DEP 力减弱,限制了其临床应用场景。
2) 未来发展方向
针对上述挑战,行业发展将聚焦三大方向:
- 集成化与高通量设计:通过 3D 电极加工、多通道并行结构优化,结合 PDMS 芯片加工设备的规模化生产,提升芯片通量;开发多层总线设计的电极阵列,降低电阻损耗,实现高吞吐量微粒操控。
- 低成本与便携化:采用 MEMS 代工服务降低电极制备成本,利用 PDMS 等低成本材料实现芯片批量生产;集成微型电源与检测模块,开发手持化器官芯片分析设备。
- 功能拓展与兼容性提升:通过表面修饰技术(如碳纳米管涂层)优化芯片在高导电缓冲溶液中的性能;结合磁泳、声学操控等多场耦合技术,拓展微粒操控的适配范围,实现复杂样本的精准分析。
介电泳技术与微流控芯片的深度融合,为生物医学领域提供了精准、高效的微粒操控解决方案。PDMS 芯片的易加工性、MEMS 微纳加工的高精度、表面修饰的功能适配性,共同推动了 DEP 技术的产业化应用。从细胞分选、纳米颗粒操控到类器官构建,DEP 驱动的微流控芯片正逐步改变临床诊断、药物研发的技术范式。未来,随着加工工艺的成熟、设备集成度的提升与应用场景的拓展,该技术将在点 – of-care 检测、个性化医疗等领域发挥更大价值,成为微流控行业的核心增长点。
参考文献:DOI 10.1002/elps.201100167
顶旭微控产品
| 产品编号 | 外形 (mm) | 电极处流道 | 电极材质 | 电极厚度 (nm) | 芯片材质 | 价格 (CNY) | |
| 高度 (um) | 宽度 (mm) | ||||||
| E0001 | 50*30 | 100 | 1 | Cr+Au | 5+100 | PDMS+Glass | 1300 |
| E0002 | 21*10 | 100 | 0.8 | Cr+Au | 5+100 | PDMS+Glass | 1000 |
| E0003 | 84*40 | 100 | 0.57 | Cr+Au | 5+100 | PDMS+Glass | 1300 |
| E0004 | 45*22.5 | 100 | 0.75 | Cr+Au | 5+100 | PDMS+Glass | 1000 |
订购方式



© 2026. All Rights Reserved. 苏ICP备2022036544号-1












