在畜牧养殖、伴侣动物健康与野生动物保护日益受重视的当下,兽医学面临着疾病防控、药物研发效率低、跨物种诊疗适配难等多重挑战。微流控技术凭借其微型化、高灵敏度、低耗材等核心优势,正成为破解这些难题的关键支撑。从 PDMS 芯片制备到 MEMS 加工的精密制造,从 3D 细胞培养芯片到动物芯片(AoC)的功能迭代,这项技术正深度融入兽医学全产业链,推动行业向精准化、高效化、伦理化方向转型。
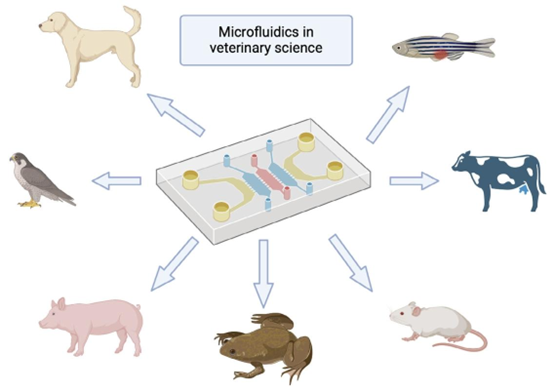
图1 兽医学的多个领域都能从微流控技术中获益,例如疾病诊断、疾病建模以及辅助生殖技术。微流控平台可针对不同动物物种进行定制。本图使用Biorender制作。
1. 微流控技术基础:从制造到核心优势
微流控技术以操控 1-1000μm 尺度的流体为核心,其核心载体微流控芯片的制造依赖于成熟的精密加工工艺。主流的制备流程融合了光刻、软光刻与等离子键合技术,通过 PDMS(聚二甲基硅氧烷)等生物相容性材料的浇筑、模塑与键合,构建出具备微通道、反应腔室的功能芯片。MEMS 加工与微纳加工平台的应用,进一步提升了芯片结构的精密性,可实现微通道尺寸精准控制、多通道集成与高通量检测设计,为兽医学多场景应用提供了硬件基础。
从流体物理特性来看,微流控系统中粘性力主导的层流现象,使得试剂混合仅依赖扩散,配合雷诺数、佩克莱数等关键参数的调控,能够精准模拟生物体内微环境的物理化学条件。这种特性赋予微流控技术三大核心优势:一是样本与试剂消耗量仅为传统方法的千分之一,大幅降低检测与研发成本;二是反应时间从小时级压缩至分钟级,实现快速诊断与高通量筛选;三是兼具高灵敏度与特异性,可实现单病原体、低浓度生物标志物的精准捕获,为早期疾病诊断提供可能。
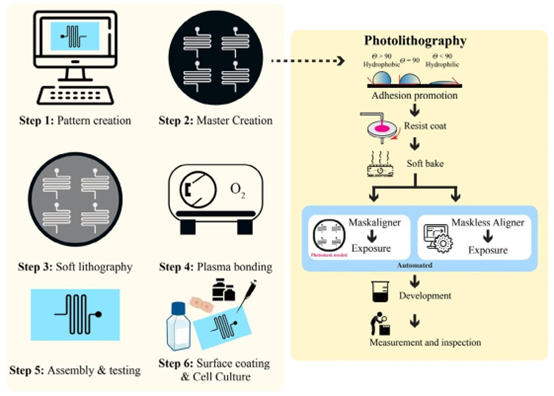
图2 利用光刻和软光刻技术分六步制作微流控LOC器件的一般流程。步骤1是图案创建,通常使用计算机辅助设计软件(如AutoCAD)完成。步骤2是在硅片上制作主模板,可选择掩模光刻或无掩模光刻。步骤3是通过软光刻制造器件。步骤4是芯片材料的等离子键合。步骤5包括从入口和出口插入管子,以及在细胞培养前对器件进行测试。步骤6展示了芯片通道的涂层和细胞接种。版权所有©2022,经AIP出版社许可转载。53
2. 微流控技术在兽医学的核心应用场景
1) 动物疾病快速检测:现场化与精准化突破
传统动物疾病检测依赖实验室设备与专业操作,难以满足养殖场、野外等场景的即时需求。微流控技术通过集成 LAMP(环介导等温扩增)、ELISA(酶联免疫吸附试验)与电化学检测模块,实现了检测设备的小型化与操作简化。基于 PDMS 芯片的手持检测装置,可将样本处理、核酸提取、扩增与检测整合于一体,针对猪流行性腹泻病毒、非洲猪瘟病毒等常见病原体,实现 1 小时内的可视化诊断,特异性与灵敏度均达到 100%。
MEMS 加工工艺打造的微纳传感器阵列,进一步拓展了检测维度。结合 ELISA 的微流控芯片通过优化表面修饰技术,将抗原 – 抗体反应效率提升 22 倍,可快速筛查牛布鲁氏菌、犬细小病毒等病原体;电化学微流控传感器则通过检测病毒蛋白引发的电极电流变化,实现猫免疫缺陷病毒(FIV)、丝状寄生虫等的无创检测,为伴侣动物与野生动物疾病监测提供了便捷工具。这些技术的落地,有效降低了 zoonotic 疾病传播风险,保障了畜牧生产安全与公共卫生安全。
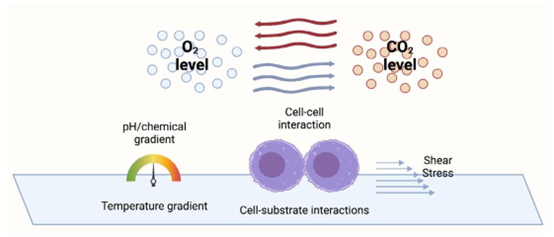
图3 细胞微环境示意图。此图显示,细胞微环境包括生物物理信号(剪切应力)、化学信号(细胞间相互作用、细胞与基质间相互作用)以及物理化学信号(pH值、氧\([O_{2}]\)和二氧化碳梯度\([CO_{2}])\))。该图使用Biorender制作。
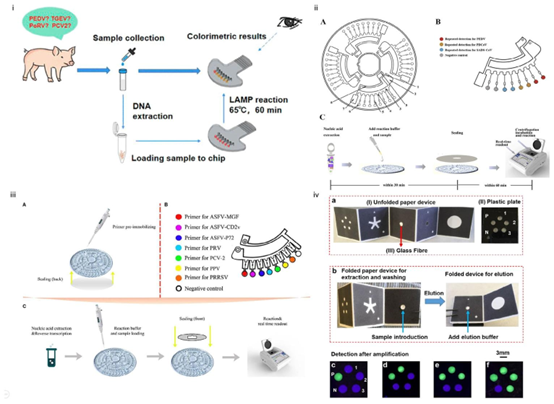
图4 本图总结了四种不同微流控装置的结构及工作流程,这些装置用于多种动物疾病的检测。(i)使用手持式可视化环介导等温扩增(LAMP)微流控芯片进行快速和多重疾病诊断的示意图及工作流程。版权所有©2022,经皇家化学会许可转载。129(ii)用于新发和再发猪肠道冠状病毒的微流控-逆转录环介导等温扩增(RT-LAMP)芯片检测平台示意图。(A)类光盘(CD)微流控芯片的结构;(B)芯片的详细视图,包括加样区、通道和反应区。版权所有©2020,经爱思唯尔许可转载。130(iii)基于微流控-环介导等温扩增(LAMP)芯片系统的多重检测示意图。(A)引物预固定和背面密封;(B)芯片的单个部分及其反应区;(C)微流控-环介导等温扩增(LAMP)芯片检测系统的整个诊断流程。版权所有©2020,经前沿(Frontiers)许可转载。131(iv)用于检测三个靶标(1、2和3)的纸质装置设计,包含内部阳性对照(P)和阴性对照(N)。(a)该装置包含三个组件:(I)带有蜡印流体通道的滤纸基流体装置;(II)带有5个环介导等温扩增(LAMP)反应室的塑料板(P、N、1、2和3代表五个反应室,对应于(c)中所示的P、N、1、2和3的图像);以及(III)一个玻璃纤维圆盘。(b)将样品引入玻璃纤维中并提取DNA,随后进行环介导等温扩增(LAMP)反应。扩增后,用紫外光(365 nm)读取信号。(c-f)在紫外激发下,当存在焦磷酸时会产生绿色发射光:(c)空白样品;1:钩端螺旋体;2:布鲁氏菌;3:牛疱疹病毒1型(BoHV-1);(d-f)是在缓冲液中加入DNA后进行单靶标(钩端螺旋体—d)、双靶标(钩端螺旋体和布鲁氏菌—e)和三靶标(钩端螺旋体、布鲁氏菌和牛疱疹病毒1型—f)检测处理后的代表性图像(\((2 ng \mu L^{-1})\))。版权所有©2018,经美国化学会许可转载。132
2) 细胞培养与动物芯片:兽药研发的新范式
兽用药物研发长期面临物种特异性差异大、动物实验伦理争议等问题。微流控技术构建的 3D 细胞培养芯片,通过模拟体内微环境的生化梯度与机械力,实现了动物细胞的高保真培养。球状体与类器官培养系统可复现肿瘤组织、肠道上皮等复杂结构,其中犬骨肉瘤球状体模型已成功用于化疗药物筛选,类器官芯片则在猪肠道感染机制研究中展现出优异的生物模拟能力。
动物芯片(AoC)作为微流控技术的高阶形态,正成为兽药研发的核心平台。通过 MEMS 加工与微纳制造技术,科研人员已开发出鱼肠道芯片、犬输卵管芯片等专用模型。这些芯片集成了多孔膜、微流道与传感器,可精准模拟器官生理功能,在药物代谢、毒性评估中展现出比传统细胞培养更可靠的预测性。例如,犬输卵管芯片通过 CRISPR-Cas9 技术构建卵巢癌模型,成功捕获了肿瘤标志物表达变化,为靶向药物研发提供了精准工具。
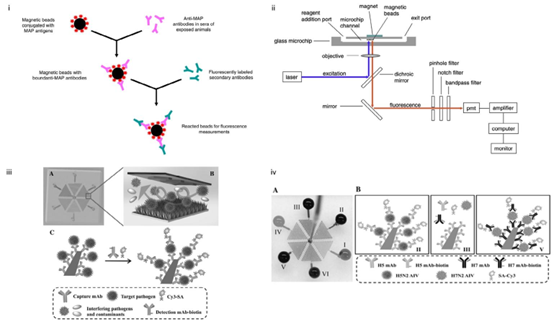
图5(i)使用磁珠的免疫荧光测定示意图。版权所有©2012,经Elsevier许可转载。148(ii)本研究中使用的微流体系统示意图。微芯片通道中充满缓冲溶液。悬浮的珠子被加入到通道端口,并通过通道迁移,在磁铁下方聚集,在这里可以使用荧光显微镜对其进行成像,或通过激光诱导荧光进行定量。版权所有©2012,经Elsevier许可转载。148(iii)在ZnO-NIM上进行多重病原体捕获和检测的原理(未按比例绘制)。(A)3D插图的俯视图,显示了微流体芯片的布局。六个分支微通道呈六边形排列,可分别加载六种不同的样品(以不同颜色突出显示)。(B)图示显示了在ZnO-NIM内部、与捕获单克隆抗体偶联的3D纳米结构ZnO表面上捕获病原体的过程。微流体通道的顶部包含人字形结构,以增强混合效果。(C)在ZnO-NIM内部的单个ZnO纳米棒上进行病原体检测的夹心免疫测定示意图。生物素标记的检测单克隆抗体(mAb-生物素)与病原体结合。荧光信号由Cy3-链霉亲和素产生。版权所有©2017,经Wiley Materials许可转载。150(iv)在一个ZnO-NIM中对H5N2和H7N2两种禽流感病毒亚型的多重检测。(A)六个分支微流体通道中的每个通道都通过将各种彩色染料溶液流入不同分支来进行操作,经Wiley Materials许可转载。150(B)微通道II与H5单克隆抗体偶联,用于H5N2禽流感病毒检测;微通道III与H5单克隆抗体偶联,但在H7N2禽流感病毒检测中失败;微通道V与H7单克隆抗体偶联,用于H7N2禽流感病毒检测。版权所有©2017,
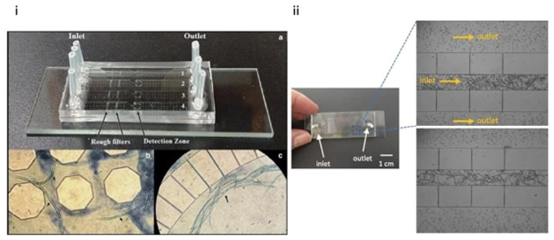
图6(i)用于检测丝虫寄生虫微丝蚴的微流控芯片。(a)该芯片包含四个检测通道;每个通道从左到右由四个部分组成:入口、粗过滤器、检测区和出口。(b)滞留在粗过滤器区域的淋巴丝虫微丝蚴的显微照片。(c)滞留在装置检测区的淋巴丝虫微丝蚴的显微照片(10倍放大)。版权所有©2019,经施普林格·自然许可转载。158(ii)微流控芯片原型(左)和被捕获的微丝蚴(右)。图像中的箭头指示流体流动方向。版权所有©2023,经《前沿》许可转载。161
3) 辅助生殖技术:物种保护与养殖升级
微流控技术为动物辅助生殖提供了精密解决方案,尤其在珍稀物种保护与优质 livestock 繁育中发挥关键作用。基于微流控芯片的精子筛选系统,利用流体动力学原理分离高活力、高 DNA 完整性的精子,筛选效率较传统离心法提升 3 倍以上,且避免了精子损伤。针对小鼠、犬等物种的睾丸组织培养芯片,通过精准调控营养供应与气体环境,实现了体外精子生成与长期维持,为珍稀动物遗传资源保存提供了新路径。
胚胎培养芯片的应用则进一步提升了繁育成功率。采用 PDMS 芯片构建的纳米升体积培养腔室,可模拟子宫内营养梯度与流体微环境,小鼠胚胎着床率较传统培养方法提升至 95%,出生存活率提高 11 个百分点。这种技术不仅适用于实验室动物繁育,更在奶牛、赛马等优质品种培育中展现出巨大潜力,为畜牧行业遗传改良提供了高效工具。
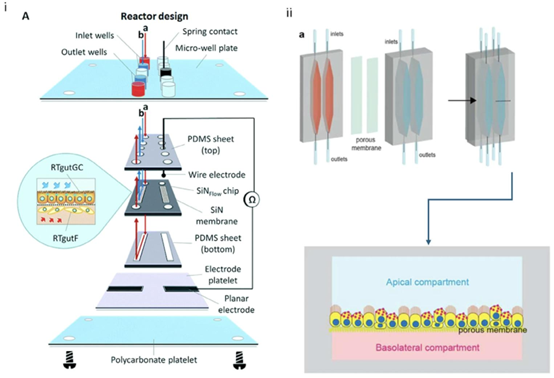
图8(i)芯片上鱼肠道模型。(A)该装置由\(SiN_{Flow }\)芯片的模块化堆叠组件构成,该芯片夹在两片PDMS之间,底部是一个电极板。这种结构从上微孔固定在改良的384微孔底部,并通过弹簧触点与反应器集成电极相连。膜放大图展示了上皮细胞RTgutGC和成纤维细胞RTgutF在膜两侧的概念性细胞培养。版权所有©2019,经皇家化学会许可转载。69(ii)芯片上输卵管模型,(a)中为装置的不同部分,包括底部(基底外侧,粉色)和顶部(顶端,蓝色)隔室,以及中间带有多孔膜的组装微流控装置;每个装置包含两个独立的腔室。右侧图显示腔室的横向切面,指示输卵管上皮在顶端隔室的多孔膜顶部生长。版权所有©2020,经施普林格·自然许可转载。8
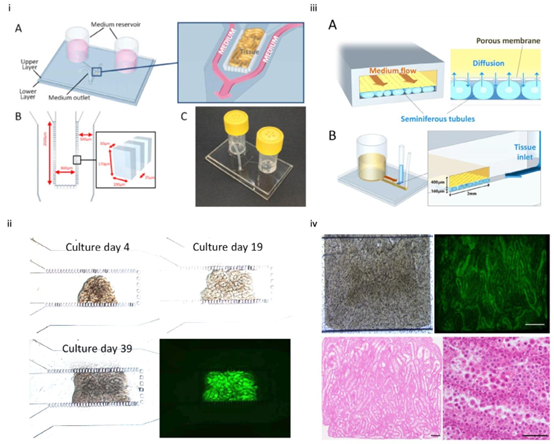
图9(i)装置设计和样品加载。(A)ML-D的示意图,它由下层玻璃层和上层PDMS层组成。上层经模塑加工形成该设计的主要特征,包括培养基流动通道和组织室。两个培养基储液槽与组织室两侧的通道相连,这些通道随后汇合形成一个出口。(B)组织室通过一排柱体与培养基流动通道隔开。(C)装置图片。版权所有©2018,经爱思唯尔许可转载。250(ii)一小片取自3.5日龄小鼠的睾丸组织,加载在组织室中央。它显示出逐渐增大和Acr–Gfp表达。版权所有©2018,经爱思唯尔许可转载。250(iii)(A)该装置的设计理念是通过多孔膜将培养基流动与组织分隔开。(B)装置的三维示意图。版权所有©2016,经施普林格·自然许可转载。252(iv)睾丸组织在组织室中平铺。在培养第42天,观察到大多数曲细精管中存在GFP表达。组织学检查证实,大多数曲细精管含有减数分裂期的生殖细胞(HE染色)。版权所有©2016,经施普林格·自然许可转载。252
3. 行业挑战与未来发展方向
尽管微流控技术在兽医学中已取得显著进展,仍面临三大核心挑战:一是芯片材料的物种适配性不足,PDMS 对部分兽药成分的吸附效应影响检测准确性;二是规模化生产难度大,MEMS 加工与微纳加工的高成本限制了技术普及;三是多物种模型缺乏,针对野生动物、特种养殖动物的专用芯片研发滞后。
未来发展将聚焦三大方向:其一,材料创新与工艺优化,开发低吸附、高耐用的芯片材料,结合 3D 打印技术降低微流控芯片定制成本;其二,多器官芯片集成,通过微流道连接构建多器官交互系统,更全面模拟动物体内代谢过程;其三,智能化与现场化融合,集成微型传感器、无线传输模块与 AI 分析算法,打造无需专业操作的全自动检测设备。此外,微流控技术与基因编辑、单细胞测序的结合,将进一步拓展在动物疫病防控、个性化兽药研发中的应用边界。
微流控技术正以其独特的技术优势,重构兽医学的疾病诊断、药物研发与繁育技术体系。从 PDMS 芯片的精密制造到动物芯片的功能突破,从养殖场的快速检测到实验室的精准研发,这项技术不仅解决了行业痛点,更推动了 “人 – 动物 – 环境” One Health 理念的落地。随着 MEMS 加工、微纳制造等支撑技术的不断成熟,以及与人工智能、生物工程的深度融合,微流控技术将成为兽医学创新发展的核心引擎,为畜牧产业升级、野生动物保护与公共卫生安全提供更坚实的技术保障。
参考文献:https://doi.org/10.1002/VIW.20240073
顶旭微控产品(标准PDMS芯片)
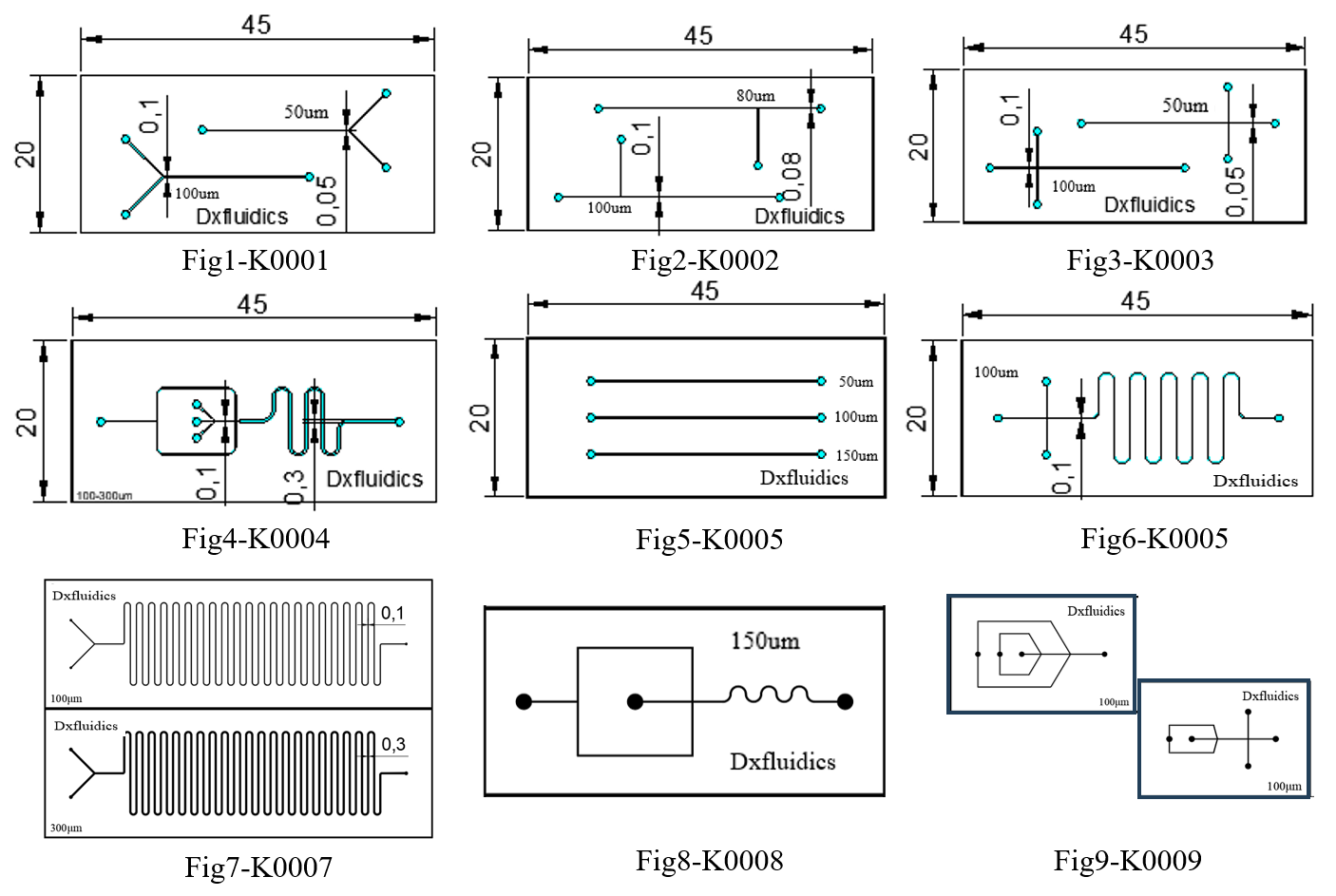
本公司也可提供特性化的微流控PDMS芯片加工服务,具体详情,欢迎来电咨询+86-17751163890(同微信),邮箱:sale@dxfluidics.com
| 产品编号 | 外形 (mm) | 高度 (um) | 宽度 (um) | 厚度 (mm) | 芯片材质 | 价格 (CNY) |
| K0001 | 45*20 | 50 | 50&100 | 3+1 | PDMS+Glass | 300 |
| K0002 | 45*20 | 50 | 80&100 | 3+1 | PDMS+Glass | 300 |
| K0003 | 45*20 | 50 | 50&100 | 3+1 | PDMS+Glass | 300 |
| K0004 | 45*20 | 50 | 100&300 | 3+1 | PDMS+Glass | 300 |
| K0005 | 45*20 | 50 | 50&100&150 | 3+1 | PDMS+Glass | 300 |
| K0006 | 45*20 | 50 | 100 | 3+1 | PDMS+Glass | 300 |
| K0007 | 75*25 | 100 | 100&300 | 3+1 | PDMS+Glass | 300 |
| K0008 | 52*25 | 100 | 100&150&200 | 3+1 | PDMS+Glass | 300 |
| K0009 | 35*24 | 100 | 100&200 | 3+1 | PDMS+Glass | 300 |
订购方式



© 2026. All Rights Reserved. 苏ICP备2022036544号-1












