1. 引言:生物医学检测中的技术痛点与创新方向
溶解氧作为生物代谢、生长及病理过程中的关键参数,其精准监测对于器官芯片、3D 细胞培养等前沿生物医学研究至关重要。传统细胞培养系统常采用 21% 的环境氧浓度,与体内 2%-9% 的生理氧水平存在显著差异,导致体外实验结果与临床实际脱节。同时,活性氧物种(ROS)的局部生成监测在生物模拟模型中长期被忽视,制约了病理机制研究与药物筛选的准确性。
在此背景下,微流控芯片技术与 MEMS 加工工艺的融合成为突破瓶颈的关键。通过整合电化学传感与微流控技术,结合 3D 打印的快速成型优势,新型检测系统实现了生理氧浓度的自动化调控与高灵敏度监测,为器官芯片、类器官培养等领域提供了更贴近体内环境的研究工具。这类技术创新不仅依赖微纳加工、光刻等核心工艺的支撑,更推动了 PDMS 芯片、3D 细胞培养芯片等产品的功能升级,成为生物医学检测设备发展的核心趋势。
2. 技术原理与系统核心设计
1) 双传感协同监测机制
该 3D 打印微流控芯片系统创新性地整合了电化学传感与光学传感技术,形成互补验证体系。电化学传感基于氧还原反应(ORR)原理,采用金电极(Au)作为对照电极,铂黑(PtB)涂层电极作为核心传感单元,通过三电极体系(工作电极、对电极、Ag/AgCl 参比电极)实现溶解氧的快速响应。铂黑电极的电沉积镀膜工艺提升了电极比表面积(较裸金电极增大 2.1 倍),显著增强了传感灵敏度。
光学传感采用商用荧光氧传感器作为验证标准,通过光纤激发传感器箔片上的荧光染料,利用氧浓度依赖性相位偏移实现定量检测。双传感机制的结合既发挥了电化学传感器响应速度快、成本效益高的优势,又借助光学传感器的稳定性保障了数据准确性,为复杂生物环境中的检测提供了双重保障。
2) 微流控芯片的一体化结构设计
系统采用高分辨率 3D 打印技术(MultiJet 打印机,xyz 轴分辨率 800×900×790 DPI)实现一体化成型,核心结构包括进样模块、HC 型微混合器、PTFE 膜气泡陷阱、传感器腔室及出样模块。微混合器通过特殊流道设计打破层流限制,确保氧富集与氧匮乏的 PBS 溶液快速均匀混合,精准调控不同生理氧浓度梯度;气泡陷阱利用 PTFE 膜的气体渗透性,有效移除流道中的气泡,避免干扰传感信号。
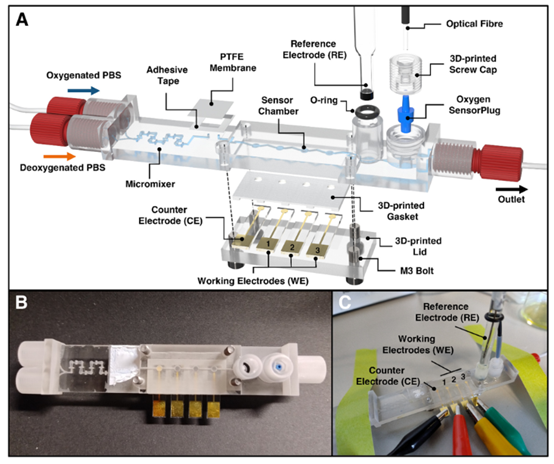
图1 用于控制和定量溶解氧的3D打印微流控LOC芯片设计示意图。(A)LOC的分解视图渲染图,展示了其特征和组装方式。LOC包含关键组件,如(1)Enders等人59提出的HC形微混合器,用于快速混合含氧和脱氧PBS;(2)气泡捕集器,包括一个透气的PTFE膜,用于去除气泡;(3)用于金和铂黑涂层电极的传感器腔;(5)玻璃参比电极;(6)作为参考的光化学氧传感器。(B)组装后的LOC俯视图照片(未包含参比电极)。(C)实验期间组装好的装置照片。该装置的组装步骤简单:(1)将金/铂黑涂层电极连接到鳄鱼夹;(2)将参比电极插入其O形圈密封端口;(3)插入氧SensorPlug,通过螺帽固定,并连接到光纤以进行读数。关于LOC的尺寸,请参见图S4–S7中所示的技术图纸。†
芯片与 PDMS 芯片加工平台的兼容性设计,使其可通过 3D 打印 gasket 与 PDMS 键合机实现密封装配,配合 M3 螺丝固定与 O 型圈密封,保障了微流道的 leak-tight 性能。这种结构设计既体现了 MEMS 加工的高精度优势,又兼容了 PDMS 芯片的灵活加工特性,为系统的规模化应用奠定了基础。
3. 核心组件与加工工艺亮点
1) 电极制备与微纳加工技术
电极的微纳加工采用光刻工艺结合薄膜沉积技术:在 4 英寸玻璃晶圆上通过 AZ-nLOF 光刻胶涂覆、曝光、显影,依次沉积 25nm 铬层与 250nm 金层,经 SU8 光刻胶定义传感器腔室后,通过划片形成独立芯片。铂黑电极的改性则通过电沉积工艺实现,将氯铂酸与醋酸铅混合溶液作为电解液,施加恒定电流密度(+230 A/m²)沉积 450 秒,形成高孔隙率的传感表面。
整个加工过程融合了 MEMS 加工的核心技术,包括光刻胶模具制备、电子束光刻辅助定位、阳极键合等工艺,确保电极尺寸精度(1mm 半径圆形电极)与表面性能的一致性。这种加工方案与 MEMS 代工服务的标准化流程兼容,具备批量生产潜力。
2) 3D 打印与 PDMS 芯片的协同优化
微流控芯片主体采用生物相容性聚 acrylate 材料 3D 打印成型,经蒸汽浴脱蜡、超声清洗等后处理工艺移除支撑材料,保障流道内壁光滑度。垫片采用软硅酮材料(AR-G1L)通过高精度 3D 打印制备,配合 PDMS 对准平台实现电极与芯片的精准定位装配。
针对 3D 打印表面粗糙度导致的气泡吸附问题,系统集成了 PTFE 膜气泡陷阱,并优化了 PDMS 芯片的键合工艺,通过氧气等离子体处理提升表面亲水性,减少气泡残留。这种 3D 打印与 PDMS 加工技术的协同,既发挥了 3D 打印快速成型的优势,又借助 PDMS 芯片的生物相容性与密封性能,满足了细胞培养与长期监测的需求。
4. 性能验证与行业应用场景
1) 核心性能指标与验证结果
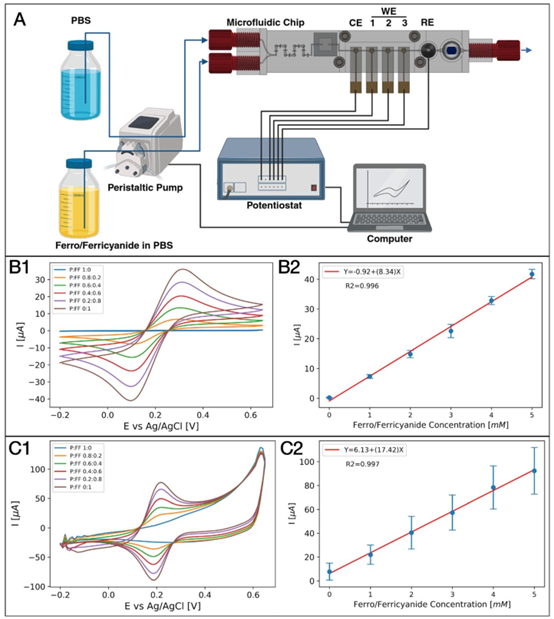
图2 LOC平台验证实验。(A) 实验装置,其中(Fcn(O/R);“FF”)和PBS(“P”)通过蠕动泵以不同比例引入,电极同步感应电活性分析物,评估Fcn(O/R)浓度和电极的有效表面积。蓝色箭头表示流体路径,黑色线条表示电连接。(CE:对电极;WE:工作电极;RE:参比电极)。(B) 使用金电极作为工作电极的循环伏安图。(1) 使用不同流量比(P:FF)的循环伏安图;(2) 阳极峰值电流与预期Fcn(O/R)浓度的函数关系,显示出正线性关系(\((R^{2}=\)为0.996),与伦德尔斯-塞夫奇克方程一致。(C) 使用涂覆铂黑(PtB)电极作为工作电极的循环伏安图。(1) 使用不同流量比(P:FF)的循环伏安图;(2) 阳极峰值电流与预期Fcn(O/R)浓度的函数关系,显示出线性关系(\((R^{2}=0.997)\)),与伦德尔斯-塞夫奇克方程一致。误差线代表LOC平台中三个工作电极的平均值(标记)和标准偏差(帽状线)。
系统经铁氰化钾 / 亚铁氰化钾 redox 对验证,表现出优异的浓度响应线性(R²>0.996),金电极与铂黑电极的有效表面积测量值与理论值高度吻合。在溶解氧检测中,铂黑电极的检测限低至 11.9±0.3μM(相当于 1.16±0.02% 氧浓度),低于多数生理组织的氧水平,且在 0-225μM 浓度范围内保持良好线性关系(R²=0.998)。
稳定性测试显示,系统在 24 小时连续运行后,电化学信号拟合方程无显著变化,表明电极与芯片结构的长期可靠性。这种高性能表现使其能够满足 3D 细胞培养芯片、类器官芯片等场景下的实时氧浓度监测需求,为缺氧 / 常氧条件模拟提供了精准工具。
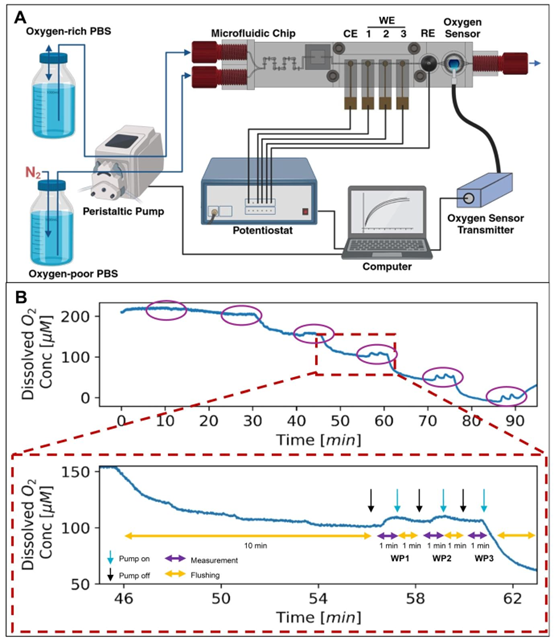
图3 微流控LOC中的溶解氧电化学检测。(A)实验装置,其中富氧(\((O_{2})\))和贫氧(\((N_{2})\))溶液由蠕动泵以不同比例输送,氧气浓度通过对氧还原反应(ORR)的计时电流法定量来测量(CE:对电极;WE:工作电极;RE:参比电极)。(B)SensorPlug在整个实验过程中的氧气信号,显示贫氧溶液比例越高,氧气水平越低。紫色圆圈突出显示了电化学测量的序列。放大到20分钟时间范围的图表展示了针对每个比例执行的测量序列:(1)冲洗10分钟,随后是测量序列;(2)停止流动10秒以释放任何残余压力;(3)对单个工作电极进行1分钟测量;(4)再冲洗1分钟。步骤2-4对每个工作电极重复进行。黑色箭头指示泵的停止,蓝色箭头指示泵的启动。
2) 多元化行业应用落地
在器官芯片领域,该系统可集成于肝器官芯片、肺器官芯片等平台,实时调控并监测组织微环境中的氧浓度,模拟体内生理或病理状态下的氧代谢过程,助力药物毒性评估与疾病机制研究。结合 3D 细胞培养芯片的三维培养特性,能够更真实地反映细胞在缺氧条件下的增殖、分化及凋亡行为。
在 MEMS 与微流控芯片定制服务中,该系统的模块化设计支持电极材料、流道结构的个性化调整,可适配不同客户的检测需求,如生物医学诊断中的 ROS 监测、环境检测中的溶解氧分析等。同时,其兼容 PDMS 芯片加工平台、MEMS 代工加工的特性,降低了行业应用的技术门槛,推动了微流控传感技术的规模化普及。
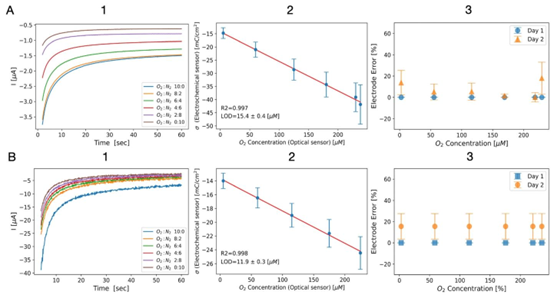
图4 基于ORR的氧传感结果,使用(A)金工作电极和(B)铂黑涂层工作电极。(1)使用不同流速比的贫氧和富氧溶液的ORR计时电流图;(2)电荷密度与光学氧传感器读数的函数关系,显示出明显的线性关系(\((Au: -14.3-0.11 ×dO_{2}\) \(R^{2}=0.997\):\(LOD =15.4 \pm 0.4 \mu M\):PtB:\(-13.7-0.05 ×dO_{2}\)。\(R^{2}=0.998\);\(LOD=11.2 \pm 0.3 \mu M\));(3)电化学LOC的稳定性测试,显示第1天(橙色)和第2天(蓝色)电荷密度随氧浓度的变化,两次测试之间无显著差异。所有误差线代表使用LOC平台的3个工作电极的平均值(标记)和标准偏差(帽状线)。LOD通过方程(2)计算,误差代表标准偏差。
5. 行业前景与发展趋势
1) 技术迭代方向
未来,该技术将重点优化 3D 打印材料的生物相容性,结合 PDMS 芯片的长效亲水处理工艺,拓展在细胞长期培养中的应用;通过集成微纳加工的高精度电极阵列,实现多参数同步检测(如溶解氧、pH 值、代谢产物)。同时,MEMS 加工工艺的升级将进一步提升芯片的微型化程度,配合阳极键合、电子束光刻等技术,开发出更紧凑的便携式检测设备。
2) 行业生态与市场拓展
随着器官芯片加工设备、微流控芯片代工服务的需求增长,该系统的产业化潜力将进一步释放。通过与 MEMS 微纳代工企业、PDMS 芯片制备设备供应商合作,可形成从核心组件加工到整体系统集成的完整产业链。此外,针对 IVD 行业的定制化需求,开发一次性微流控芯片产品,将推动技术在临床诊断、现场检测等领域的广泛应用。
3) 政策与技术协同驱动
在生物医学工程的政策支持下,微流控芯片、器官芯片等领域成为科技创新的重点方向。该技术融合了 3D 打印、MEMS 加工、电化学传感等多学科优势,符合 “精准医疗”“个性化医疗” 的发展趋势,有望通过与高校、科研机构的合作,加速技术转化与临床应用,为生物医学检测行业注入新的活力。
3D 打印微流控芯片与电化学传感技术的创新融合,解决了生物医学研究中生理氧浓度精准监测的核心痛点,为器官芯片、3D 细胞培养等领域提供了高性能检测工具。其整合 MEMS 加工、PDMS 芯片技术、光刻工艺等行业核心技术的特性,不仅保障了系统的检测精度与稳定性,更推动了微流控传感技术的标准化与产业化发展。未来,随着加工工艺的持续优化与应用场景的不断拓展,该技术将在生物医学检测、药物研发、临床诊断等领域发挥更大价值,引领微流控与器官芯片行业的技术升级与市场拓展。
参考文献:DOI: 10.1039/d4lc00962b
订购方式



© 2026. All Rights Reserved. 苏ICP备2022036544号-1












