在全球约 3% 的人群受银屑病困扰的背景下,这种慢性炎症性皮肤病因复杂的发病机制和个体差异,长期面临诊断不准确、治疗效果不佳的困境。传统诊疗手段依赖主观皮肤观察和侵入性检测,不仅耗时耗力,还难以实现个性化干预。而人工智能(AI)与微流控技术的跨界融合,通过 PDMS 芯片、器官芯片、MEMS 加工等核心器件与智能算法的协同,正为银屑病的精准诊疗带来颠覆性变革,成为生物医药领域的研究热点。
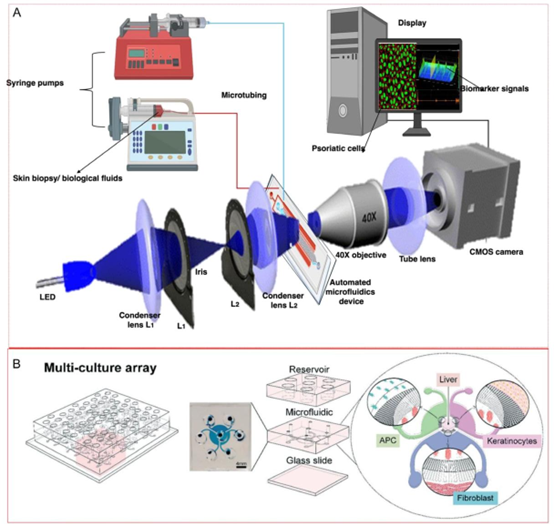
图1. 用于治疗和细胞筛选的智能微流控平台。A) 用于银屑病和其他皮肤病筛查及精确诊断的微流控装置。图中展示了一种通用微流控显微系统的示意图,该系统利用激光和显微镜等光学系统进行成像,并检测生物相互作用以实现高通量成像。图中还展示了微流控装置的设置,包括用于流体控制的注射泵、微流控器件和成像系统,这些设备用于进行和捕捉精确的流体实验及细胞行为。经许可转载并稍作修改。[41] B) 由多个通过微流控通道相互连接的储液器组成的多元培养阵列设计。该系统可同时培养和分析不同类型的细胞(肝细胞、角质形成细胞、成纤维细胞和抗原呈递细胞(APC)免疫细胞)。该平台通过允许不同隔室之间共享培养基和可扩散信号来模拟组织间的相互作用,从而创造出动态的组织环境。[80] 经许可转载。版权所有2022,英国皇家化学会(RSC)。C) 该图展示了用于细胞研究的多元培养系统中的组织相互作用和生物测定区域,非常适合同时进行多项分析。图中详细展示了用于药物代谢研究的器官芯片模型的生物技术表征,显示了不同细胞类型的整合以及相应的生化途径,这有助于更好地理解银屑病及其相关疾病。图中展示了复杂细胞共培养平台的荧光图像,该平台模拟了表皮角质形成细胞与肝细胞(HepaRG肝细胞)、真皮成纤维细胞、APC免疫细胞以及参与免疫反应的U937单核细胞之间的相互作用,其中肝细胞可激活药物并产生代谢物。扩散微通道调节这些区域之间可溶性因子的交换,肝脏隔室代谢药物后,药物会扩散到周围细胞中。[80] 经许可转载。版权所有2022,英国皇家化学会(RSC)。
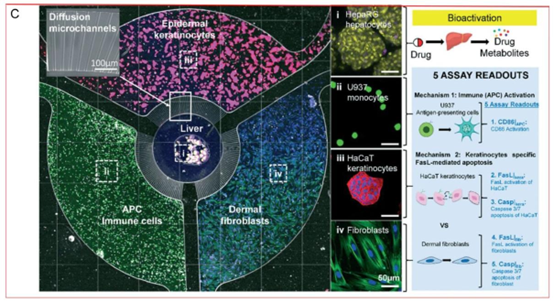
图1. 续图。
1. 微流控技术:银屑病研究的核心支撑平台
微流控技术以其精准操控微尺度流体的特性,成为银屑病基础研究与临床应用的关键工具。其核心载体 PDMS 芯片通过光刻、软光刻、3D 打印等 MEMS 加工技术制备,借助 PDMS 键合对准平台实现微通道的精准密封与组装,可高效处理血液、汗液、皮肤组织等微量生物样本,大幅降低检测成本与侵入性。
在银屑病建模方面,类器官微流控芯片(即 3D 细胞培养芯片)通过模拟皮肤组织的生理微环境,重现角质形成细胞、免疫细胞的相互作用,为研究疾病发病机制提供了更贴近体内的实验模型。这类芯片的表面常经过醛基化修饰、PEG 修饰等表面修饰处理,增强生物相容性与分子结合特异性,提升生物标志物(BMs)检测的灵敏度。而在药物递送领域,微流控芯片可制备纳米载体(如脂质体、聚合物纳米粒),配合微针阵列实现药物的靶向、可控释放,解决传统外用药物渗透率低、副作用明显的问题。
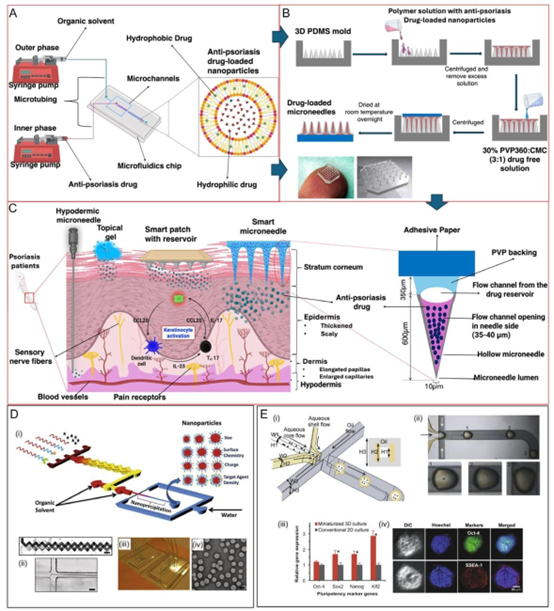
图2. 用于药物递送的微流控平台。A)用于生产载药脂质纳米颗粒的微流控系统示意图。两个注射泵将水溶液和有机溶液供应到基于PDMS的微流控芯片,脂质纳米颗粒在其中通过受控的流体动力学聚焦自组装。其结构表现为带有脂质 bilayer且负载治疗剂的球形囊泡。B)用于生产皮肤递送用微针阵列的模具示意图。C)银屑病皮肤和载药微针的放大横截面示意图,详细展示了银屑病涉及的关键细胞成分,如活化的角质形成细胞、树突状细胞和T细胞。包括微针系统在内的局部药剂已被证实可靶向该特定区域,释放治疗性纳米制剂以调节免疫反应并抑制银屑病进展。载药纳米制剂紧邻皮肤的炎症区域。D)用于快速、组合合成纳米颗粒的微流控平台示意图。i)展示了微流控纳米沉淀装置,其中不同材料与有机溶剂和水通过PDMS芯片中的流体动力流混合以生成纳米颗粒。右侧展示了具有不同特性(如尺寸、表面电荷和官能团)的纳米颗粒。ii)微流控通道流体动力学流聚焦的放大图像,显示对混合的精确控制,其中纳米颗粒通过纳米沉淀自组装。iii)使用该方法生产纳米颗粒的实例。iv)通过该工艺形成的纳米颗粒的TEM图像。E)用于药物测试的3D细胞培养。i)旨在利用水包油液滴生成技术创建3D细胞培养的微流控芯片示意图。细胞被包封在水凝胶液滴中以模拟3D环境。ii)显示液滴中均匀包封的显微镜图像;iii)比较3D培养与传统2D培养中基因表达水平的柱状图。iv)免疫荧光染色显示3D培养细胞中的多能性标志物,表明在微流控平台内成功培养了干细胞。F)基于免疫磁分离和微流控技术相结合的磁驱动微流控系统示意图,用于高通量检测全细胞。该系统采用磁场引导磁性纳米颗粒在流体内并沿流动方向移动。系统配备显微镜以进行实时观察。G)单细胞分选和分析。i)用于分离和分选单细胞的微流控芯片设计。细胞根据其大小、变形能力和生化标志物被导向不同的通道。i-a)双T型接头实现平行液滴生成及单细胞包封。i-b)通过侧面电极对产生电场,激活液滴对并使其融合;i-c)在分叉处通过液体抽吸减少融合液滴的体积;i-d)通过微通道两端的电极对驱动实现细胞融合。ii)显示通道中分选的单个细胞及其后续融合的显微镜图像。d-g)经许可转载。[81]版权所有2016,爱思唯尔。
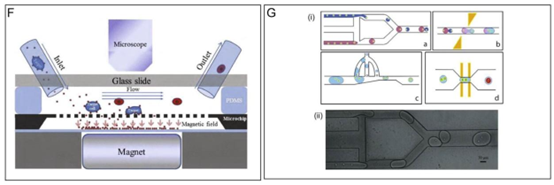
图2. 续图。
此外,微流控芯片的多功能集成特性使其可实现多指标同步检测。例如,结合电化学传感器与光学传感器的 PDMS 芯片,能同时分析银屑病相关的细胞因子(IL-6、IL-17)、离子浓度(Na⁺、K⁺)等生物标志物,为疾病诊断提供全面数据支持。而 MEMS 加工技术的进步,进一步推动了微流控器件的微型化、便携化,为基层医疗场景的快速检测奠定基础。
2. AI 技术:赋能银屑病诊疗的智能核心
AI 算法的强大数据分析与模式识别能力,为微流控技术的效能升级提供了关键支撑。在诊断环节,基于 CNN(卷积神经网络)的 AI 模型可分析皮肤 lesion 图像与微流控芯片采集的生物标志物数据,精准区分银屑病与湿疹、脂溢性皮炎等相似皮肤病,诊断准确率已接近甚至超越资深 dermatologist。结合 SVM(支持向量机)与随机森林算法,还能实现银屑病分型(斑块状、点滴状等)与严重程度的量化评估,解决传统诊断的主观性难题。
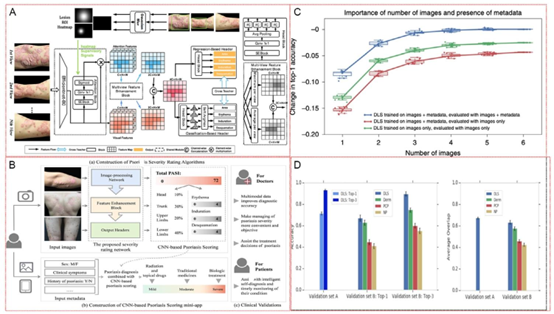
图3. 用于银屑病诊断和准确性评估的人工智能模型。A)皮肤病变诊断工作流程展示了使用决策支持系统的皮肤病变综合诊断工作流程。该工作流程结合了病变组织病理学、多光谱成像和预测算法对皮肤病变进行分类。其中包括病变图像采集、特征提取和统计分析,最终生成各种皮肤状况的诊断概率和风险评估。B)银屑病严重程度评分算法的构建,详细说明了用于银屑病严重程度评分的卷积神经网络(CNN)架构。该图包括图像和临床元数据的输入层、特征增强块以及提供严重程度评分的输出层。它还强调了临床输入与图像处理的整合,以实现更精确的诊断。A和B转载自Huang等人,遵循知识共享署名许可协议(https://creativecommons.org/licenses/by/4.0/)。C)说明了训练的人工智能模型的准确性与图像数量和元数据之间的关系。这展示了深度学习系统的性能如何随图像数量和元数据的纳入而变化。该图展示了三种情况:基于带元数据的图像训练的深度学习系统、仅基于图像训练的深度学习系统,以及这两种系统在有元数据和无元数据情况下的评估,表明当元数据被纳入人工智能模型的训练中时,诊断准确性有显著提高。经许可转载。[36]版权所有2019,施普林格·自然。D)一张图表展示了所开发的人工智能诊断设备的临床验证,其中柱状图比较了医护人员与训练有素的人工智能模型在诊断皮肤病方面的准确性。经许可转载。[36]版权所有2019,施普林格·自然。
在治疗方案优化方面,AI 通过挖掘微流控芯片产生的海量数据(如细胞对药物的反应、生物标志物动态变化),构建个性化治疗模型。例如,LSTM(长短期记忆网络)可追踪患者长期的炎症指标变化,预测病情复发风险,为调整用药方案提供依据。而在药物筛选领域,AI 算法能快速分析微流控高通量筛选平台产生的实验数据,识别潜在有效药物分子,缩短研发周期。
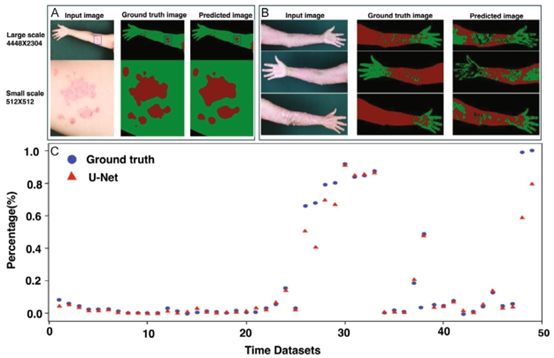
图4. 不同图像尺度和数据集下模型在皮肤病变分割任务中的性能评估。A)展示了基于人工智能的银屑病皮肤病变分割及其相应的分割输出。利用U-Net架构的人工智能模型被用于识别红色标记的银屑病区域与绿色标记的健康皮肤。模型的分割结果被叠加到图像上,以突出显示受影响区域。B)U-Net架构人工智能模型在不同身体部位的预测与真实标签的性能比较。红色和绿色区域分别表示银屑病病变和健康皮肤。C)该图表展示了不同测试图像中病变分割的真实标签与U-Net模型预测之间的定量比较数据。经许可转载。[113]版权所有2022,威利在线图书馆。
AI 与微流控的协同还体现在智能控制上。通过机器学习算法优化微流控芯片的流体流速、温度调节、试剂配比等参数,可实现实验过程的自动化与精准化。例如,基于 Bayesian 优化的 AI 系统能实时调整 PDMS 芯片的微通道压力,确保纳米载体合成的均一性,提升药物递送效率。
3. AI + 微流控融合:构建银屑病诊疗一体化平台
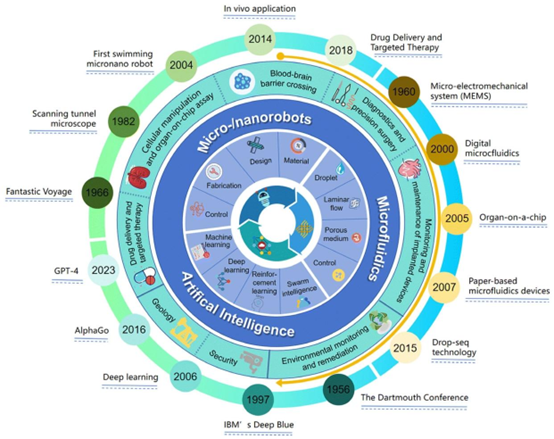
图5. 人工智能集成微流控平台以及人工智能控制的微/纳米机器人领域在生物医学研究、诊断和治疗中的进展与里程碑综合时间线示意图,突出展示了这些技术协同发展的演变过程。[114] 经许可转载。版权所有2024,英国皇家化学会(RSC)。
AI 与微流控的深度融合,形成了集 “检测 – 分析 – 干预” 于一体的智能诊疗平台。这类平台以定制化微流控芯片为核心,集成 PDMS 键合对准平台、表面修饰传感器、AI 数据分析模块,实现从样本采集到治疗方案输出的全流程自动化。
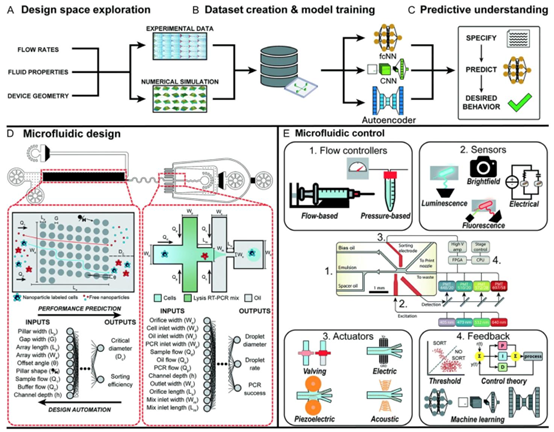
图6. 人工智能驱动的智能微流控系统设计与控制概述。A–C)智能微流控器件设计的设计空间探索和预测性理解,展示了设计阶段探索的关键参数,如流速、流体性质和器件几何形状。它还展示了数据集创建和模型训练过程,包括收集实验数据和运行数值模拟。图中描述了使用全连接神经网络(fcNN)、卷积神经网络(CNN)和自编码器等人工智能模型进行预测性理解的模型训练,这使得能够指定期望结果以提高系统效率和功能。D)展示了具有人工智能自动化的智能微流控设计,其中人工智能模型预测分选效率和关键参数。图中描述了设计输入(包括孔口宽度、样品流速和液滴直径)以及设计输出(包括液滴分选成功率和聚合酶链式反应(PCR)反应速率)。E)智能微流控控制模块示意图,包括通过基于压力或基于流量的机制调节流体运动的流量控制器、提供系统监控反馈的传感器、控制液滴和阀门操作的执行器,以及机器学习算法等反馈回路,用于实时优化系统性能。F)使用反向模型进行直接设计自动化的示意图。i)使用卷积神经网络进行流动塑造,基于预测的柱序列生成所需的流动形状。ii)展示了浓度梯度生成,其采用全连接神经网络优化目标分布的入口压力和浓度。G)展示了利用正向模型进行迭代设计自动化,描述了随机网格混合和流动聚焦液滴生成,通过性能预测和实时调整之间的迭代反馈来改进微流控设计[117]。经许可转载。版权所有2022,英国皇家化学会(RSC)。
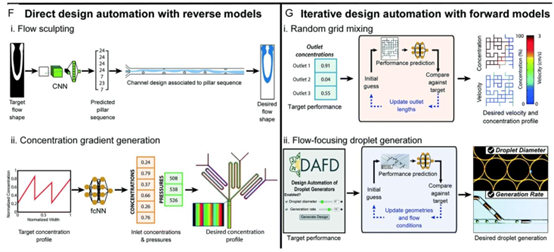
图6. 续图。
在临床应用中,智能微流控平台已展现出显著优势。例如,通过 3D 打印制备的 PDMS 芯片可采集患者汗液样本,经表面修饰的传感器检测炎症相关离子与细胞因子,数据实时传输至 AI 系统进行分析,10 分钟内即可生成诊断报告与初步治疗建议。而在药物研发领域,类器官微流控芯片结合 AI 算法,能模拟不同患者的皮肤微环境,预测药物疗效与副作用,为精准用药提供依据。
MEMS 加工技术的精细化发展,进一步推动了融合平台的性能提升。通过电子束光刻、深硅刻蚀等工艺,可制备具有复杂微通道结构的微流控芯片,实现细胞分选、单分子检测等高端功能。配合 PDMS 热板、烘箱等加工设备,确保芯片批量生产的一致性,为技术规模化应用提供保障。
4. 技术挑战与优化方向
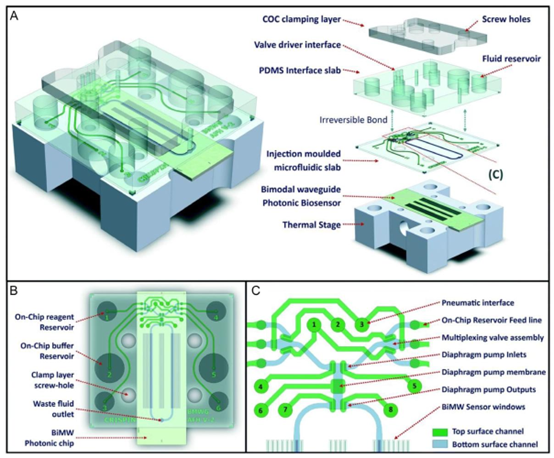
紧邻传感器阵列,使流体能够与光子传感器相互作用,随后光子传感器捕获信号以进行进一步分析。高密度结构详细呈现了复杂的流体通道,包括用于通过受控气压驱动流体流动的气动接口、多路阀组件、用于精确调节流体运动的隔膜泵膜,以及用于确保流体系统多层功能的不同顶面和底面通道。图7. 智能传感器与微流控平台的集成。A)带有集成智能传感器的3D微流控装置示意图,展示了微流控系统的多层结构。该装置包括一个环烯烃共聚物夹持层(通过螺孔提供结构支撑和固定)、一个PDMS接口板(促进外部流体储液器与内部通道之间的连接)、一个注塑成型的微流控板(包含流体通道)、一个双峰波导光子生物传感器(用于实时检测生化反应),以及一个热台(可调节微流控平台内特定反应的温度)。B)微流控布局的俯视图,显示了微流控芯片的顶视图,详细标注了芯片上的试剂和缓冲液储液器(为微流控通道供液以进行样品制备或分析)、废液出口以及双峰波导光子芯片的位置——该芯片对于分析物流经通道时的信号检测和定量至关重要。C)带有气动和阀门控制的微流控通道设计示意图,用于检测各种生化变化,包括与银屑病BMs相关的变化。照片还显示了微流控通道。A–C)经许可转载。[170] 版权所有2017,英国皇家化学会(RSC)。D)传感器阵列与光子波导集成的照片,显示了一个128传感器阵列,连接到输入光栅耦合器和输出波导。该传感器阵列显著提高了平台的检测灵敏度和吞吐量,实现了稳健的实时诊断。经许可重印。[128] 版权所有2019,爱思唯尔。
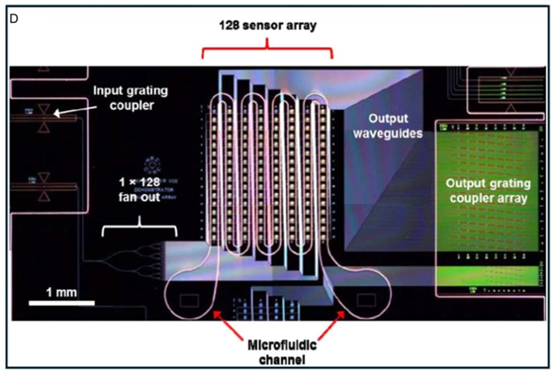
图7. 续表。
尽管 AI 与微流控融合技术前景广阔,仍面临诸多现实挑战。在加工层面,PDMS 芯片的微通道尺寸均匀性、键合稳定性依赖高精度 MEMS 加工设备,现有技术难以平衡成本与精度;表面修饰的长效性不足,可能影响传感器的检测稳定性。在算法层面,AI 模型的训练依赖大量高质量临床数据,而银屑病的个体差异导致数据多样性不足,可能降低模型的泛化能力。
针对这些问题,行业正通过多技术融合寻求突破。例如,将激光纳米加工系统引入 PDMS 芯片制备,提升微通道加工精度;开发长效亲水 / 疏水修饰技术,延长传感器使用寿命;采用联邦学习模式,在保护数据隐私的前提下整合多中心数据,优化 AI 模型。同时,微流控芯片定制服务的普及,可根据不同临床需求调整芯片结构与功能,提升技术的适配性。
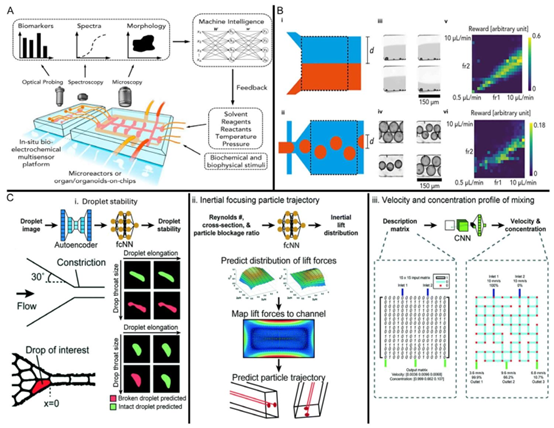
颗粒。iii)速度和浓度分布:卷积神经网络(CNN)被用于预测微流体混合中的速度和浓度分布。该系统采用微流体配置以实现精确的双流控制。该系统在微通道内操控流体液滴,其中蓝色和红色指示微通道内的颗粒轨迹。人工智能系统预测升力,并将其映射到通道几何结构,以在银屑病相关实验中精确引导生物物理刺激。B)具有人工智能优化流量控制的液滴微流体技术。i、ii) 不同液滴的示意图 图8. 用于银屑病治疗和诊断的先进人工智能集成微流体平台。A) 具有时间反馈的人工智能集成微流控器官芯片系统。这种人工智能驱动的系统能够精确控制溶剂试剂、反应物、温度和压力,以模拟生化过程和生成(从0.5到\(10 \mu L min^{-1}\)),提高液滴形成的一致性。A和B经许可转载。版权所有2020,爱思唯尔(Elsevier)。表示强化学习优化的奖励值。这些图谱展示了人工智能模型如何提高液滴中流速的精度。在各种条件下生成的液滴的显微图像,显示对液滴大小和均匀性的控制。v、vi)热图代表两种不互溶的相:油和水。虚线表示采样区域,距离d是需要优化的参数。iii、iv)预测液滴会破裂还是保持完整。ii)颗粒的惯性聚焦:此图说明了如何利用惯性聚焦编码器和全连接神经网络(fcNN)预测液滴的伸长和稳定性。液滴图像是在其通过收缩部时捕获的,人工智能模型C)人工智能引导的微流体操作和颗粒动力学。i)液滴稳定性分析:此子图展示了一个人工智能驱动的系统,其中平台能够收集多种数据类型,包括生物标志物(BMs)、光谱和形态,这些数据被输入到机器智能模块进行实时生物样本分析。该系统包括集成到器官芯片或微反应器平台中的光学探测、光谱学和显微镜技术。实时分析。此示意图展示了一个多传感器微流体平台,该平台整合了机器学习算法,用于实时分析通道内的分布。C)经许可转载。版权所有2022,英国皇家化学会(RSC)。使用描述矩阵作为输入,该矩阵由入口条件组成,并输出对流速和浓度分布的精确预测[117]
5. 未来展望:迈向个性化、普惠化的银屑病治疗
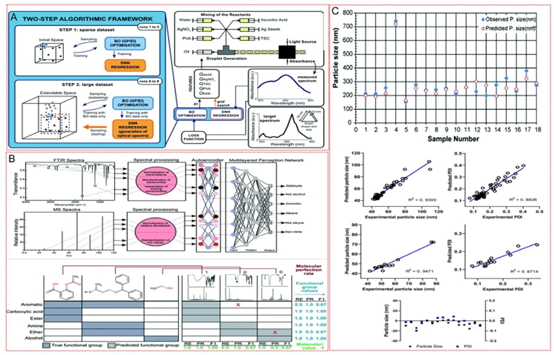
图9. 用于材料合成的人工智能集成微流控系统。A)材料科学中预测建模的两步算法框架示意图。第一步涉及使用统计分析和机器学习模型进行数据预处理和特征选择。第二步是预测建模,其中应用最终算法基于所选特征预测材料特性。辅助图表展示了实验条件与材料特性之间的关系。B)光谱处理和预测,展示了光谱数据处理和预测的工作流程。该面板包括傅里叶变换红外光谱、质谱数据、光谱处理模块,以及一个集成神经网络的示意图,该神经网络旨在从处理后的光谱数据中预测分子官能团。下部突出显示了预测的官能团与使用传统方法测量的真实值之间的准确性。经许可转载。[37] 版权所有2021,英国皇家化学会(RSC),以及C)预测性能验证显示了人工智能模型的预测性能。它包括比较颗粒大小和多分散指数的预测值与实验值的散点图,展示了高相关系数。另一幅图显示了样品的实验粒径分布与预测粒径分布,强调了模型的准确性和可靠性。经许可转载。[126] 版权所有2022,美国化学会出版物。
AI 与微流控技术的融合,正推动银屑病治疗从 “标准化” 向 “个性化” 转型。未来,集成微流控芯片的可穿戴设备将实现病情的实时监测,AI 系统根据动态数据自动调整药物递送方案,实现 “按需治疗”。而类器官微流控芯片与 AI 的结合,将构建 “患者专属” 的药物筛选模型,大幅提升治疗成功率。
在技术普及方面,随着 MEMS 加工成本的降低与 PDMS 芯片制备工艺的简化,智能微流控平台将逐步下沉至社区医院与基层诊所。配合远程 AI 诊断系统,可有效解决优质医疗资源分布不均的问题,让更多患者享受精准诊疗服务。此外,多技术的跨界融合(如微流控 + AI + 基因检测)将进一步揭示银屑病的发病机制,为开发根治性疗法提供可能。
AI 与微流控技术的融合不仅为银屑病治疗带来革命性突破,更重塑了皮肤病诊疗的技术范式。从 PDMS 芯片的精准制备到 AI 算法的智能分析,从类器官模型的生理模拟到个性化治疗方案的实时优化,这项技术正以 “精准、高效、微创” 的核心优势,推动生物医药领域的发展。随着加工技术的升级、算法的优化与临床数据的积累,AI + 微流控必将成为银屑病等慢性皮肤病治疗的核心手段,为患者带来更高质量的健康保障。
参考文献:DOI: 10.1002/aisy.202400558
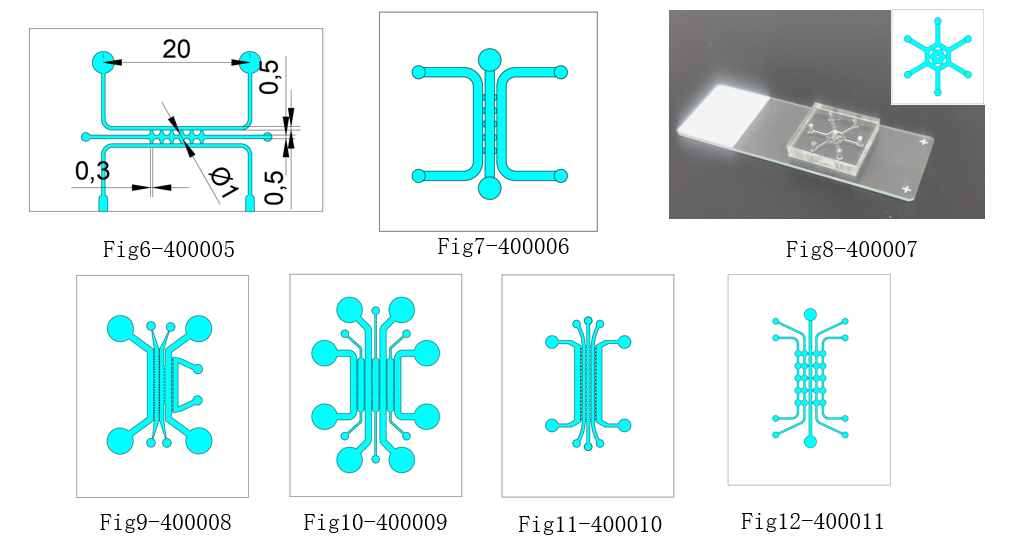
顶旭微控产品
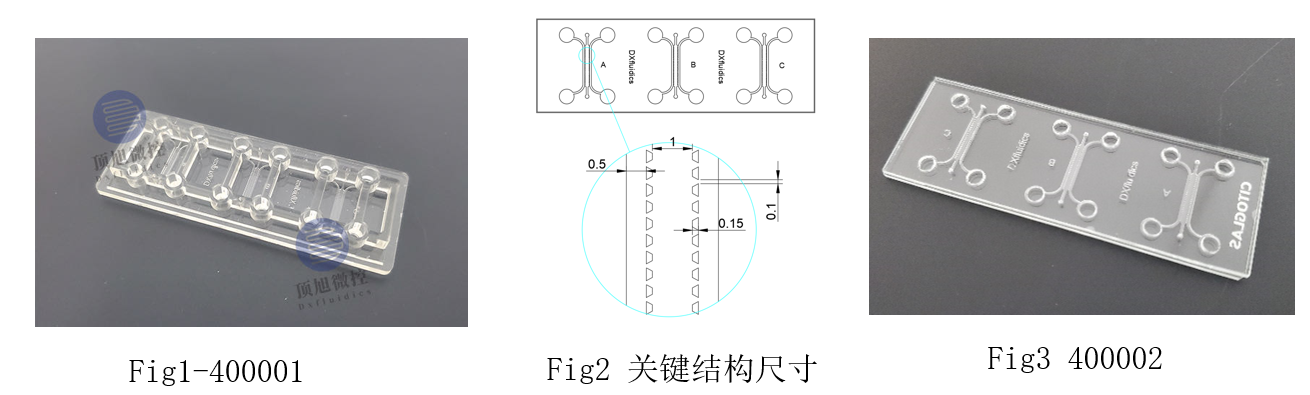

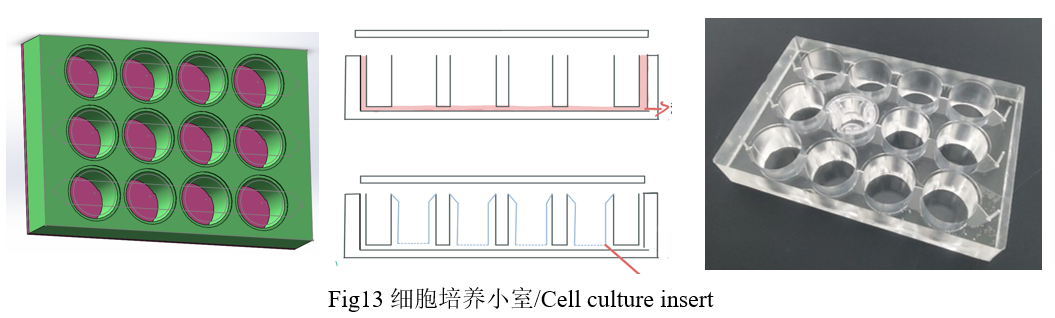
细胞小室是放置在培养皿或孔板内的可渗透膜或支持系统。它通常用于细胞培养实验中,以创建一个屏障或隔室,用于研究膜的两侧细胞或物质之间的相互作用。插入物允许可溶性因子的交换,同时物理上分离不同的细胞群体或环境。本产品采用PDMS材质,每个小室在底部,有微通道相连。
订购方式



© 2026. All Rights Reserved. 苏ICP备2022036544号-1












