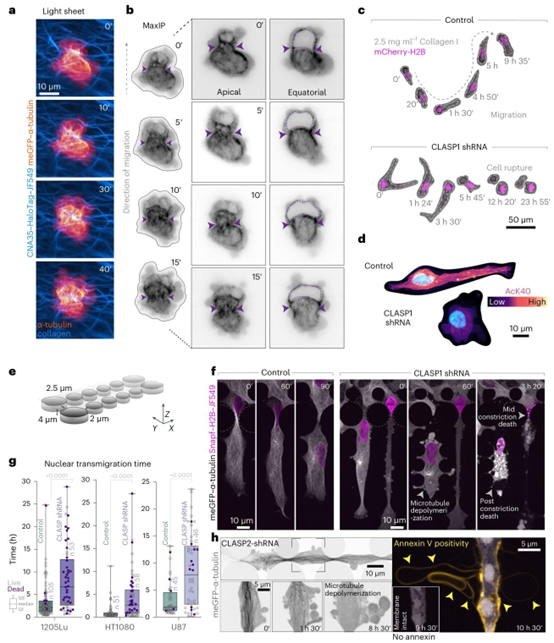
水凝胶(CNA35-HaloTag-JF549)。LSFM 体积成像显示,当细胞在基质纤维之间挤压时,微管会发生结构动态变化。b,选定的帧(0-15分钟)显示了a中细胞的顶端和赤道Z切片,展示了在核收缩阶段(紫色箭头)微管的组织(meGFP-α-微管蛋白,对比度反转)。紫色虚线勾勒出细胞核。c,CLASP1缺失会导致细胞在3D迁移过程中破裂。对照组(非靶向)和CLASP1缺失的核标记(mCherry-H2B)1205Lu细胞在3D I型胶原蛋白水凝胶中迁移的代表性时间序列。虚线代表细胞轮廓。在CLASP缺失的细胞中,破裂后的细胞碎片表明细胞死亡。d,在I型胶原蛋白水凝胶中,对照组(非靶向)和CLASP1缺失细胞中乙酰化α-微管蛋白(AcK40)的免疫荧光。e,PDMS收缩微通道设计。圆柱体代表PDMS支柱,以特定间距形成收缩结构。所有图像中的支柱均用虚线标记。支柱之间的收缩部分为4μm×2.5μm。f,在收缩微通道中,带有荧光标记微管(meGFP-α-微管蛋白)和细胞核(Snapf-H2B-JF549)的1205Lu细胞的转盘共聚焦显微镜时间序列。收缩支柱用灰色虚线标记。CLASP1缺失导致细胞破裂和死亡。g,CLASP1缺失细胞的核穿过支柱的迁移时间增加。对照组的\(n=105\) 53、51、58、45和46个细胞,分别对应CLASP shRNA 1205Lu黑色素瘤、HT1080纤维肉瘤和U-87胶质母细胞瘤细胞。所示数据代表一个实验。实验重复两次,结果相似。CLASP缺失导致微通道中细胞死亡增加(活细胞,浅灰色点;死细胞,深紫色点)。箱线图显示了中位数、第一和第三四分位数(箱体)以及95%置信区间(凹槽),须线延伸至1.5×四分位距内的最远观测值。点均为各个数据点。统计分析采用双尾Mann-Whitney检验。h,内源性表达meGFP-α-微管蛋白(灰色;对比度反转)的CLASP2缺失1205Lu细胞在受限环境中迁移的代表性图像。顶部面板的放大区域(旋转90度,对比度反转):微管解聚与过度膜 blebbing(1小时30分钟至8小时30分钟)同时发生,并先于膜联蛋白阳性(9小时30分钟至10小时30分钟,膜联蛋白V-647,黄色)。仅在膜联蛋白阳性时显示其图像(10小时30分钟)。PDMS,聚二甲基硅氧烷。
1. 研究背景:受限环境中细胞迁移的机械挑战与微流控模拟需求
在生理环境中,细胞需穿越基质孔隙、组织间隙等受限空间,这一过程面临巨大机械压力 —— 尤其是细胞核作为细胞内最大且最坚硬的细胞器,其变形与迁移是受限迁移的核心障碍。长期以来,学界对细胞如何感知并抵抗压缩力的机制知之甚少,而这一问题在 3D 细胞培养、器官芯片开发等领域具有关键意义。
当前,微流控技术已成为模拟生理受限环境的核心手段,例如通过 PDMS 芯片制备技术构建的微通道的、类器官微流控芯片,可精准控制细胞所处的机械微环境。文献中提到,研究团队采用 reticulated 胶原水凝胶与 PDMS 微通道(由 PDMS 模具制备,间隙 2-2.5×4μm)模拟体内 3D 受限空间,这与工业界常用的微流控细胞培养芯片、三维细胞培养芯片的设计逻辑高度一致 —— 通过微纳加工平台(如 MEMS 加工系统)制造的精细结构,复现细胞在体内面临的机械约束。
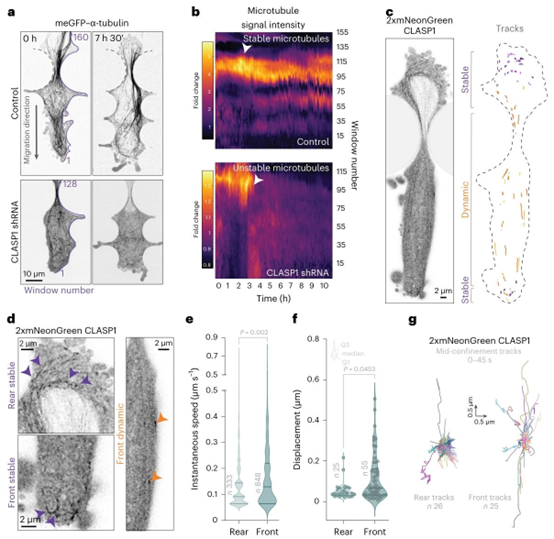
图2 | CLASP在受限迁移中表现出空间上不同的亚细胞动态。a,在微通道中受到机械挤压时,CLASP1缺失的微管会不稳定。对照(非靶向)和CLASP1缺失的1205Lu细胞(内源性表达meGFP–α-微管蛋白)的代表性延时图像。定量窗口在11小时内随细胞边缘动态包裹(紫线显示窗口位置)。b,a中边缘定量窗口的运动轨迹图显示,在受限通道中,CLASP1缺失细胞的微管发生解聚。热图显示的是每种条件下生物学独立的代表性细胞的数据。c,表达2xmNeonGreen-CLASP1的1205Lu细胞通过微通道狭窄处迁移。45秒内的CLASP1动态显示出稳定(紫色)和动态(橙色)微管结合的不同池。d,放大区域显示后部和前部区域的CLASP动态。e,狭窄期间细胞后部和前部区域的CLASP1动态(瞬时速度)。瞬时速度是从以1秒间隔获取的图像中进行的帧间测量。来自单个细胞的后部和前部分别有\(n=848\)次和333次帧间测量。点表示单个数据点。统计分析采用双尾Mann–Whitney检验。所示数据代表一个实验。实验重复两次,结果相似。f,狭窄期间细胞后部和前部区域的CLASP1彗星状结构位移。轨迹位移来自单个轨迹。来自单个细胞的前部和后部彗星状结构轨迹分别为\(n=55\)个和25个。所示数据代表一个实验。实验重复两次,结果相似。统计分析采用双尾Mann–Whitney检验。e、f中的小提琴图显示最小值、第一四分位数、中位数、第三四分位数和最大值,宽度表示数值的频率。g,在核中期阻塞期间,细胞前部和后部区域的CLASP1(2xmNeonGreenCLASP1)轨迹的蜘蛛图,持续45秒。来自单个细胞的后部和前部轨迹分别为\(n=26\)个和25个。所示数据代表一个实验。实验重复两次,结果相似。数据以蜘蛛图形式展示。原始数值数据可在原始数据中获取。
2. 实验设计:微流控与显微技术的协同应用
为解析微管在受限迁移中的作用,研究团队整合了多种关键技术,其中多项技术与行业核心加工、检测手段直接关联:
- 受限环境构建:采用 PDMS 微通道(通过 SU8 光刻胶模具制备,经等离子键合固定于玻璃基底)模拟胶原凝胶中的孔隙,通道尺寸与微流控芯片加工中常见的 “细胞级通道”(如 2-10μm)匹配,可通过 PDMS 键合对准平台精准控制通道间隙,确保实验重复性。
- 成像技术:结合活体光片荧光显微镜(LSFM)与 3D 结构光照明显微镜(3D-SIM),观察内源性标记微管(α-tubulin–meGFP)的动态,这一技术路径可直接应用于微流控芯片检测 —— 例如在微流控芯片检测仪中,实时监测类器官芯片、liver-chip 等器件内细胞的微管行为。
- 细胞模型:选用高迁移性的 1205Lu 黑色素瘤细胞(及 HT1080 肉瘤、U-87 胶质母细胞瘤细胞),模拟 “快速收缩型”(A2 型)迁移模式,这类细胞在器官芯片(如 organ-on-a-chip)、3D 细胞培养芯片中常作为研究迁移的模型,其行为与临床肿瘤侵袭、组织修复等场景高度相关。
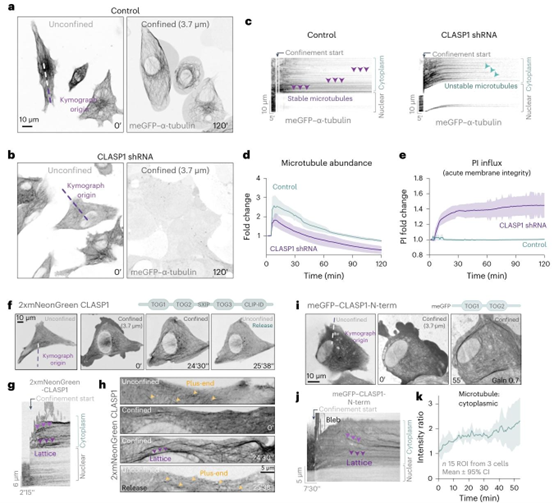
图3 | CLASP依赖的微管稳定作用使细胞能够承受轴向限制。a、b,对照组(非靶向)(a)和CLASP1缺失的1205Lu细胞(b)的代表性延时成像,这些细胞内源性表达meGFP–α-微管蛋白,分别拍摄于轴向限制(3.7 μm)前和期间。c,meGFP–微管蛋白的运动轨迹图显示,CLASP1缺失细胞中的微管减少。d,通过微管面积(丰度)的倍数变化来衡量轴向限制期间微管稳定性的定量分析。数据来自4个独立视野,每个视野至少包含3个细胞。图表显示平均值±标准差。e,在2小时内,对表达内源性meGFP–α-微管蛋白和核标记物Snapf-H2B-(Snap-JF646)的对照组(非靶向)或CLASP1缺失(CLASP1 shRNA)的1205Lu细胞进行轴向限制期间,急性碘化丙啶(PI)流入倍数变化的定量分析。对PI阳性细胞核进行计数。数据来自多个独立视野,每个视野至少包含3个细胞。图表显示平均值±标准差。采用双尾曼-惠特尼检验进行统计分析。f,在动态轴向限制下,2xmNeonGreen-CLASP1在微管正端和网格之间切换定位。g,f中区域的CLASP运动轨迹图。h,轴向限制下CLASP1机械动力学的高倍放大图。i,meGFP–CLASP1 N端(TOG1和TOG2,缺乏EB结合SxIP基序)压缩诱导的微管负载的代表性延时成像。所示数据代表一个实验。实验重复两次,结果相似。数值数据可在源数据中获取。j,i中区域的CLASP运动轨迹图。k,meGFP–CLASP1 N端微管结合动力学的平均值。meGFP微管与细胞质荧光强度比值曲线,以时间为函数进行测量。meGFP–CLASP1 N端在非限制条件下位于细胞质中。数据为来自3个细胞的多个独立感兴趣区域的汇总结果。图表显示平均值±95%置信区间。源数据可供参考。
3. 核心发现一:受限环境中的微管笼结构与 CLASPs 的稳定作用
研究首次观察到,在 3D 受限环境中(如胶原水凝胶或 PDMS 微通道),微管并非随机分布,而是形成笼状结构—— 紧密包裹细胞核并沿细胞皮层排列,且在细胞穿越狭窄通道时(如微流控芯片中的 “瓶颈型通道”),微管会在收缩点富集。这种结构与 2D 培养中分散的微管形态差异显著,提示受限环境会重塑微管组织。
进一步研究发现,细胞质连接相关蛋白(CLASPs) 是维持这一笼状结构的关键:
- CLASPs 作为微管正极追踪蛋白(+TIPs),可修复机械损伤的微管晶格(通过局部替换 Tubulin 二聚体),并促进 α- 微管蛋白的乙酰化(AcK40)—— 乙酰化的微管更耐弯曲、稳定性更高,这一特性在微流控芯片设计中具有重要参考价值:例如在 PDMS 微流控芯片中,若需细胞长期维持迁移能力,需确保芯片内机械环境不会过度破坏微管乙酰化状态。
- CLASPs 缺失会导致微管解聚、细胞在受限通道中破裂(如 PDMS 微通道中,CLASP 敲低细胞的核迁移时间延长 2-3 倍,死亡率提升 40%)。这一结果对器官芯片开发尤为关键 —— 例如在 kidney-chip、brain-chip 等器件中,需通过 MEMS 代工加工优化通道表面特性,减少对 CLASPs 功能的干扰,避免细胞活性下降。
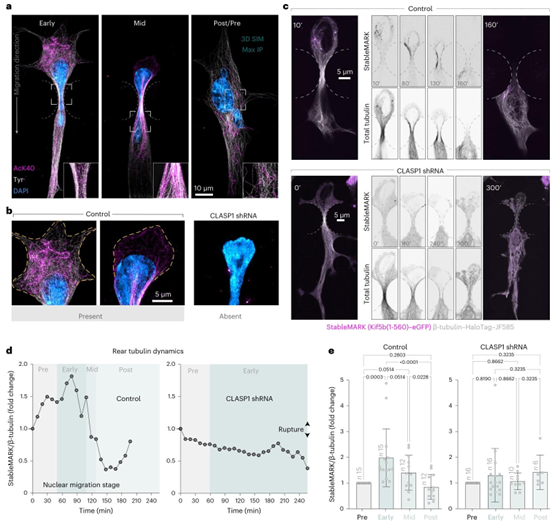
图4 | CLASPs在受限迁移中稳定微管的后部区域。a,处于核收缩早期、中期及前后阶段的对照(非靶向)1205Lu细胞的3D结构照明显微图像。核收缩前后的细胞不与任何柱体接触。对1205Lu细胞中的乙酰化α-微管蛋白(AcK40)和酪氨酸化α-微管蛋白(Tyr)进行免疫标记;细胞核用4,6-二脒基-2-苯基吲哚(DAPI)标记。b,处于受限状态的对照细胞和CLASP1缺失细胞的放大区域。CLASP1缺失细胞的后部区域缺乏微管。c,共表达StableMARK(Kif5b(1-560)–eGFP)和β-微管蛋白(TUBB5–HaloTag–JF585)的对照细胞与CLASP缺失的1205Lu细胞在核迁移过程中的延时图像。在对照细胞中,StableMARK与细胞核后方后部区域的微管相关联。对照细胞中,后部微管的StableMARK标记动态模式与a中乙酰化(AcK40)免疫标记的微管相似。在CLASP缺失细胞中检测不到StableMARK信号。d,来自c中代表性细胞的稳定微管与总微管的荧光强度曲线,该曲线为核迁移过程中随时间变化的测量结果。数据以扣除背景后的StableMARK/β-微管蛋白的倍数变化形式呈现。e,在对照细胞和CLASP缺失细胞中,核收缩早期、中期及后期,StableMARK荧光强度相对于总β-微管蛋白的增加量定量分析。在核收缩前、早期、中期和后期,对照细胞的数量分别为6、12、12和12个(编号\(n=15,15\))。在核收缩前、早期、中期和后期,CLASP1短发夹RNA(shRNA)处理的细胞数量分别为6、10、10和6个(编号\(n=16,16\))。所示数据为一次实验的结果。实验重复两次,结果相似。数据以平均值±标准差表示。统计分析采用Kruskal–Wallis检验,并结合两阶段逐步提升的Benjamini、Kriefer和Yekutieli校正方法以控制错误发现率。q值显示在图上。原始数值数据可在源数据中获取。
4. 核心发现二:机械响应性 CLASP 定位与 “微管机械传感器” 机制
研究的核心突破在于揭示了 CLASPs 的机械响应性定位,并提出 “微管机械传感器(Mechanostat)” 模型:当细胞进入受限空间(如微流控芯片的狭窄通道),细胞核会堵塞通道,将细胞分为前后两个隔室。此时, rear 隔室的微管因压缩产生晶格损伤,CLASPs 会被动态招募至损伤位点,形成两个功能池:
- 稳定池:位于核后方的 CLASPs 保持静态,修复并强化微管,形成 “微管缓冲结构”—— 这一结构可抵抗 rear 皮层收缩产生的压力,避免细胞核直接受压;
- 动态池:位于核前方的 CLASPs 随微管正极生长移动,维持前端微管的动态性。
这种定位依赖 CLASPs 的 N 端 TOG1/TOG2 结构域与微管的直接结合,且不依赖 SxIP 或 CLIP-ID 结构域。这一机制解释了为何在不同机械特性的微流控芯片中(如 PDMS 芯片 vs. 硅基微流控芯片),细胞迁移能力存在差异 —— 硅基芯片的高硬度可能增强微管压缩,促进 CLASPs 招募,而 PDMS 的弹性则可能缓冲压力,减少微管损伤。
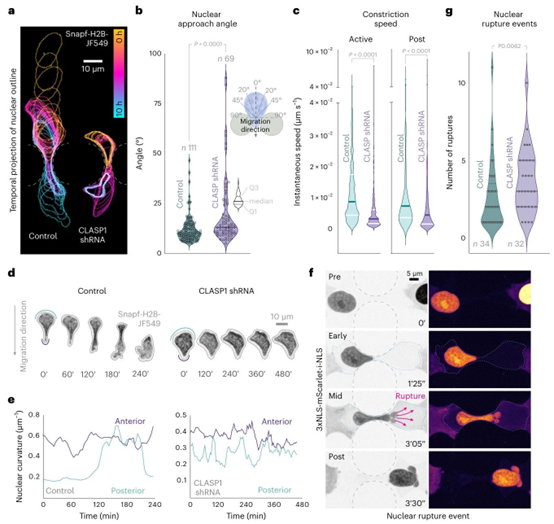
图5 | CLASP1缺失细胞在受限迁移中无法定位和保护细胞核。a,对照组(非靶向)和CLASP1缺失细胞在微通道中发生收缩时细胞核轮廓的时间彩色编码投影。b,细胞核接近角度的定量分析和示意图。角度是利用细胞核接触柱体的第一帧创建的。通过沿迁移方向在两个收缩柱体之间绘制一条中线,并沿细胞核长轴绘制第二条线来测量角度。细胞核接近角度是这两条线之间的夹角。对照组和CLASP shRNA组分别有\(n=111\)个和69个细胞核。所示数据代表一个实验。实验重复两次,结果相似。统计分析采用双尾Mann-Whitney检验。c,细胞核主动收缩期间和收缩后的瞬时细胞速度;比较对照组(非靶向)和CLASP1缺失细胞(CLASP1 shRNA)。主动收缩阶段的瞬时速度测量中,对照组57个细胞的测量值为\(n=876\)个帧-帧测量值,CLASP1 shRNA组54个细胞的测量值为\(n=1,415\)个。收缩后阶段的瞬时速度测量中,对照组57个细胞的测量值为\(n=1,257\)个帧-帧测量值,CLASP1 shRNA组54个细胞的测量值为\(n=1,414\)个。所示数据代表一个实验。实验重复两次,结果相似。统计分析采用双尾Mann-Whitney检验。d,Snapf-H2B-JF549I标记的细胞核、对照组和CLASP1缺失细胞的代表性延时图像。e,c中正在收缩的细胞的细胞核前表面和后表面的曲率图表。细胞核前表面曲率保持稳定,而后表面曲率仅在细胞核通过收缩部位时增加。CLASP1缺失会改变细胞核曲率动态。单个代表性细胞的细胞核前后曲率的平均测量值。帧以5分钟的间隔捕获。f,对照组细胞中细胞核破裂事件的代表性图像。强度热图伪彩色(右)显示,随着可溶性NLS核信号减弱,细胞质信号增强,表明在核阻塞期间发生了核破裂事件(中)。对照组和CLASP shRNA组分别有32个细胞。所示数据代表第三个四分位数和最大值,宽度表示值的频率;统计分析采用双尾Mann-Whitney检验。原始数值数据可在原始数据中获取。g,在受限环境中迁移的对照组和CLASP1缺失细胞中核破裂事件的定量分析。\(n=34\)和实验。实验重复两次,结果相似。b、c、g中的数据以小提琴图显示,指示最小值、第一四分位数、中位数。
5. 核心发现三:微管缓冲结构调控核迁移与收缩性平衡
在受限迁移中,细胞核的正确定位与变形是关键,而微管缓冲结构通过两大途径调控这一过程:
1) 核定位与保护
CLASPs 强化的微管缓冲结构会在核后方形成 “支撑垫”,确保细胞核长轴与迁移方向对齐(在微流控芯片中,这一对齐可使核迁移效率提升 30% 以上)。若 CLASPs 缺失,细胞核会错位(如 approach angle 偏离迁移方向 > 20°),且核破裂率提升 3 倍 —— 这对 3D 细胞培养芯片、类器官微流控芯片的设计警示:需通过微流控芯片设计优化通道走向,减少核错位风险,例如采用 “渐变型通道” 而非 “直角型通道”。
2) 收缩性时空调控
微管缓冲结构还通过调控肌动球蛋白收缩性控制核迁移:当 rear 隔室压力达到阈值时,微管缓冲结构会逐步解聚,释放结合的 GEF-H1(RhoA 激活因子),触发 RhoA 介导的 rear 皮层收缩 —— 这一 “收缩爆发” 会产生足够压力推动细胞核穿越狭窄通道。
这一过程在微流控技术中可转化为:在微流控细胞芯片中,通过调控芯片通道的机械阻力(如通过 MEMS 加工改变通道内壁粗糙度),可精准控制微管解聚时机,进而调节细胞收缩性 —— 例如在细胞共培养 transwell 芯片中,可通过此机制促进细胞穿越 transwell 膜,模拟体内细胞浸润过程。
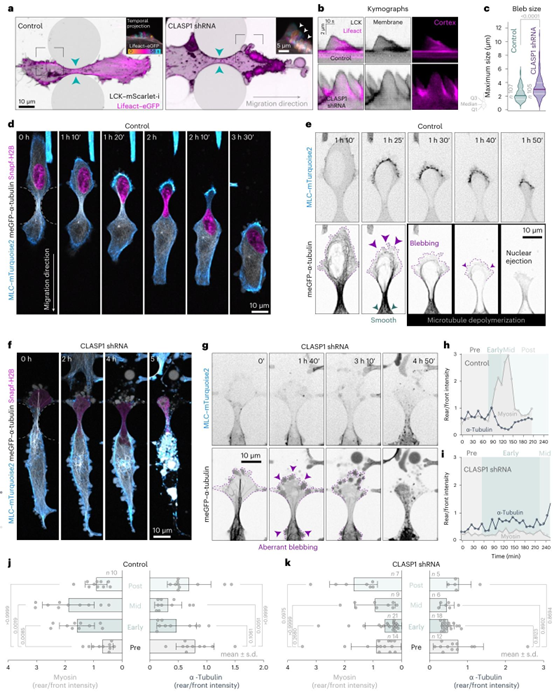
图6 | 收缩性在受限细胞中通过CLASP1增强的微管进行协调。a,对照(非靶向)和CLASP1敲除细胞的延时图像,这些细胞共表达膜标记(LCK–mScarlet-I)和皮质标记(eGFP–Lifeact),正在微通道中经历核收缩。
6. 数学模型与行业转化价值
研究团队构建了数学模型,量化微管缓冲结构、皮层张力与核迁移的关系,模型参数(如核弹性阻力、胞质压力梯度)可直接指导微流控芯片开发:
- 通道尺寸优化:模型预测,当通道间隙为细胞核直径的 1.2-1.5 倍时,微管缓冲结构的作用最显著,核迁移效率最高 —— 这为 3D 细胞培养芯片、器官芯片的通道设计提供了量化标准,例如 liver-chip 中肝细胞的核直径约 8μm,通道间隙应设计为 10-12μm。
- 材料选择参考:模型显示,芯片材料的弹性模量(PDMS 约 1-10MPa,硅约 100GPa)会影响胞质压力分布,PDMS 的低弹性更适合模拟软组织中的受限环境,而硅基芯片更适合研究高机械阻力下的细胞响应(如骨组织中的细胞迁移)。
从行业应用看,这一研究为多个领域提供了新方向:
- 微流控芯片代工:MEMS 代工加工企业可基于此机制,开发 “细胞力学友好型” 芯片 —— 例如在光刻代工过程中,通过紫外掩膜光刻机精准控制通道边缘平滑度,减少微管损伤;
- 器官芯片开发:在 organ-on-a-chip、多器官芯片中,可集成 “微管状态检测模块”(如通过微流控芯片 PCR 检测 AcK40 的表达),实时评估细胞所处的机械状态;
- 仪器设备升级:PDMS 等离子键合机、PDMS 对准平台等设备可增加 “压力反馈功能”,避免加工过程中过度压力破坏芯片内预培养细胞的微管结构。
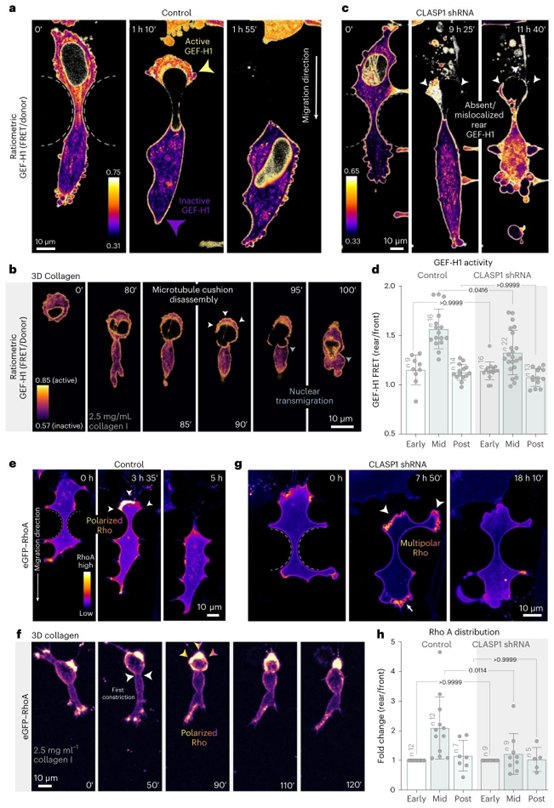
在胶原蛋白水凝胶中发生核迁移的细胞后部区域,可观察到GEF-H1活性增强(图7b、扩展数据图9d及补充视频18)。与我们对肌球蛋白定位的观察结果一致,缺乏微管缓冲结构的CLASP缺失细胞无法将GEF-H1活性集中到细胞后部(图7c(CLASP1 shRNA)及补充视频17)。对后部GEF-H1活性的定量分析显示,当核发生阻塞时,对照细胞的GEF-H1活性显著高于CLASP缺失细胞(图7d;中部)。此外,发生核迁移的细胞在核后方出现Rho定位(eGFP-RhoA)爆发44(图7e、f、扩展数据图9g及补充视频19、20),这与核移位前瞬间后部区域的微管解聚(图6e)和GEF释放(图7a、d)在时间上相关。这种协同的Rho聚集在CLASP缺失细胞中也不存在(图7g、h;CLASP1 shRNA)。相反,在数小时内,Rho聚集在细胞膜的不同位置波动,既包括前部区域也包括后部区域\((>8 h)\)。这些异常的Rho动态与无效迁移同时发生,此时细胞会在收缩状态下来回振荡(补充视频19)。因此,CLASP对微管缓冲结构的机械强化作用实现了对微管收缩轴的时空控制,使细胞能够高效地在受限环境中穿行。
7. 总结:微管机械传感器机制对微流控与细胞工程的启示
这篇研究不仅揭示了细胞应对受限环境的核心机制,更搭建了 “基础细胞力学” 与 “微流控技术应用” 的桥梁:
- 对微流控芯片制造商:需将 “细胞微管响应” 纳入芯片设计指标,例如在微流控芯片定制中,根据目标细胞类型(如肿瘤细胞 vs. 干细胞)调整通道尺寸与材料弹性;
- 对MEMS 加工领域:微纳加工实验室可开发 “机械梯度芯片”(如通道宽度从 5μm 渐变至 20μm),用于高通量筛选微管对不同机械约束的响应;
- 对细胞检测领域:微流控芯片检测仪可增加 “微管乙酰化检测通道”,通过荧光标记 AcK40,快速评估芯片内细胞的活性与迁移潜力。
未来,随着微流控技术与细胞力学研究的深度融合,基于 “微管机械传感器” 机制的器件(如智能响应型器官芯片、机械调控型 3D 细胞培养芯片)有望成为研究疾病机制、筛选药物的核心平台,推动精准医学与再生医学的发展。
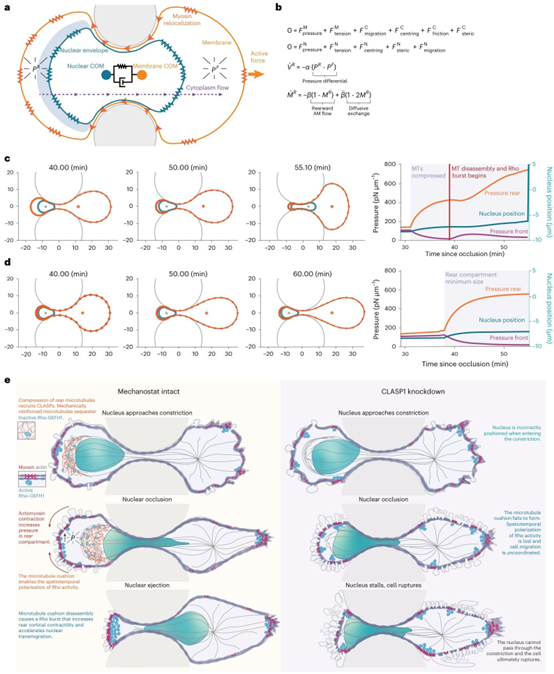
研究表明,CLASPs对微管的局部强化构成了一种机械传感器,使细胞能够(1)正确定位细胞核,以及(2)时空协调肌动球蛋白的收缩性,从而产生克服核阻塞所需的胞质静水压。我们认为,当细胞后部区域达到足够的胞质静水压时,微管缓冲垫开始解体并释放GEF-H1(参考文献51)。这会激活后部膜上由RhoA介导的最后一轮收缩爆发,增加细胞核的移动速度,使细胞核能够脱离狭窄区域。
参考文献:https://doi.org/10.1038/s41556-024-01476-x
© 2026. All Rights Reserved. 苏ICP备2022036544号-1



.png&w=120&h=120&zc=1&q=100)









