1. OOC、HO 和 OrgOC 简介
1) OOC
器官芯片(OOC)是一种可在微流控装置中重建人体器官关键结构和功能单元的体外微系统,能够模拟原生器官的多种生理微环境因素,如流体剪切应力、机械拉伸、3D 结构和氧梯度,从而调控细胞行为并维持长期培养的细胞活力。
OOC 的设计通常基于对靶器官解剖和功能的还原分析,并通过光刻、蚀刻、3D 生物打印等微加工技术构建分区空间,形成如肺、肠道、血脑等屏障及功能性界面,实现多细胞共培养与复杂生物过程模拟。
2) HO
类器官(HO)是源自人类多能干细胞(PSC)或成体干细胞(AdSC)的三维多细胞结构,能通过自组织重建目标器官的生理结构与功能。
PSC 衍生 HO 通过胚层分化路径添加特定生长因子诱导生成,适用于构建复杂、多细胞器官结构,如心脏、肝脏等,而 AdSC 衍生 HO 则依赖从成体组织中分离干细胞,结合 ECM 和外源因子更快速生成器官局部结构,适合个体化医疗。
3) OrgOCs
OrgOCs(类器官芯片)是结合类器官(HOs)与器官芯片(OOCs)两项前沿技术的高度仿生体外模型,自2019年首次提出以来,广泛应用于药物研发、疾病建模和精准医疗。
OrgOCs 构建遵循器官发育原理,融合细胞分布设计、生化微环境模拟与微结构制造,实现功能优化。
其突破性优势在于利用微工程技术(如微孔结构、液滴微流控、湿法纺丝、3D 生物打印)提高类器官的一致性和系统可控性,同时集成传感器、AI、多组学和基因编辑等技术,实现高通量、实时监测与精确分析。
2. OrgOC 在生物医学应用方面的进展
1) 生物学研究
a) 器官发育
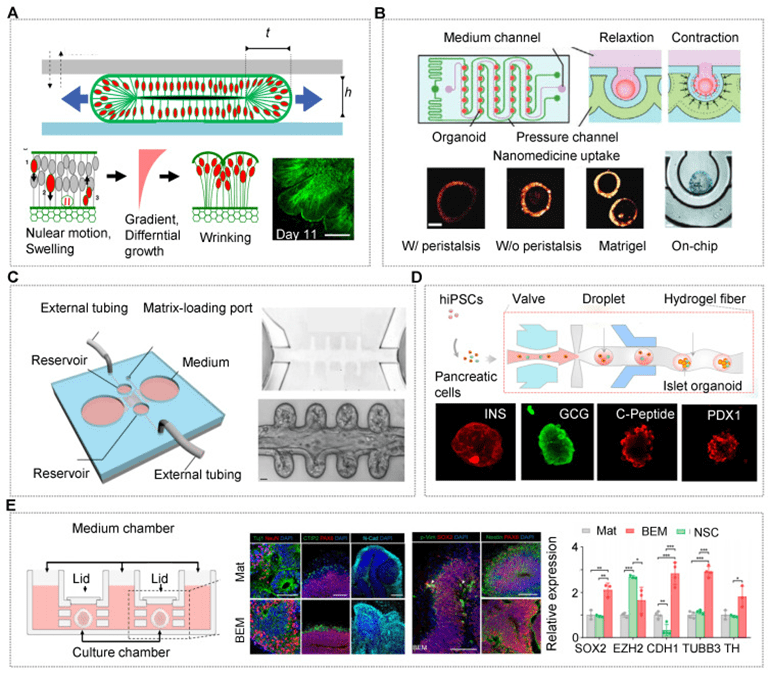
OrgOCs 技术通过体外重建整合物理、化学、生物和机械因素,模拟器官发育和功能。
该平台不仅有助于激活干细胞行为和研究器官形态发生的物理机制,还能利用微结构设计、动态流体、3D 拓扑、空间限制和机械刺激等手段调控类器官的形成、分化和成熟。
研究显示,动态流增强器官功能表达,ECM 及其硬度则通过影响细胞行为进一步优化模型生理相关性。
b) 血管化
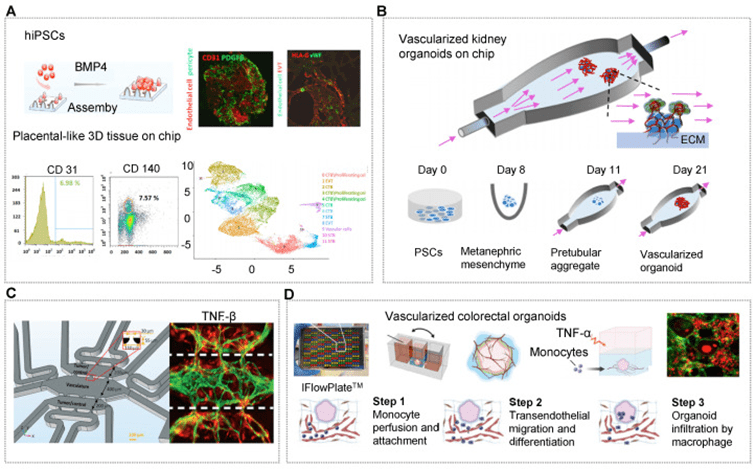
微血管系统作为输送营养、氧气、废物和免疫细胞的关键管道,在体内组织与器官的发育中起着重要作用,并通过脉管系统实现各器官功能的协同。
类器官的血管化可通过体外血管生成策略实现,如在芯片中引导内皮细胞与间充质细胞自组装形成毛细血管网络,或通过诱导多能干细胞产生内源性血管细胞。
c) 宿主免疫反应
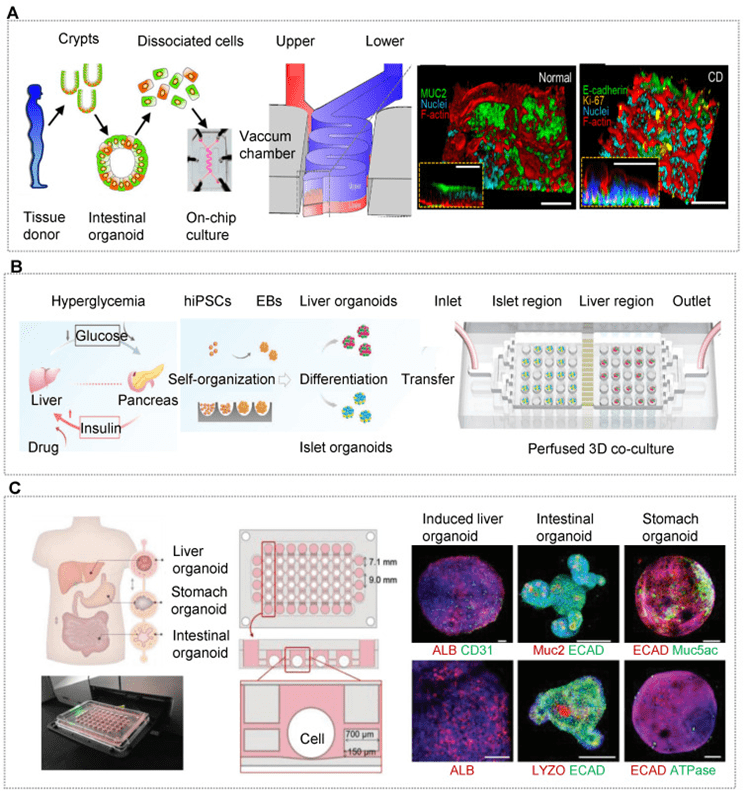
近年来,肠道微生物群在人体健康与疾病中的关键作用被广泛认识,特别是在肠道上皮、免疫细胞与微生物之间复杂串扰的研究中。
器官芯片(OOC)技术的发展使得在微环境中重建肠道屏障、免疫系统和微生物群成为可能,模拟如炎症、屏障损伤、免疫细胞募集等生理病理过程。
例如,通过共培养免疫细胞和致敏肠上皮,研究人员揭示了氧化应激和炎症因子分泌机制,而益生菌虽能缓解氧化应激,却无法修复屏障。
d) 器官间通讯
目前多数器官芯片(OOC)模型为单一器官,难以模拟体内复杂的器官间相互作用,因此研究者正致力于构建多器官芯片系统,通过微流体通道和微泵连接多个器官等效物,以实现动态循环和生理通讯。
尽管尚无公认的体外模型标准,研究者通过能量代谢与异速生长理论提出缩放方法,并优化器官比例和培养基流速,显著提高了芯片系统的生理相关性。
2) 疾病建模
a) 内生因素
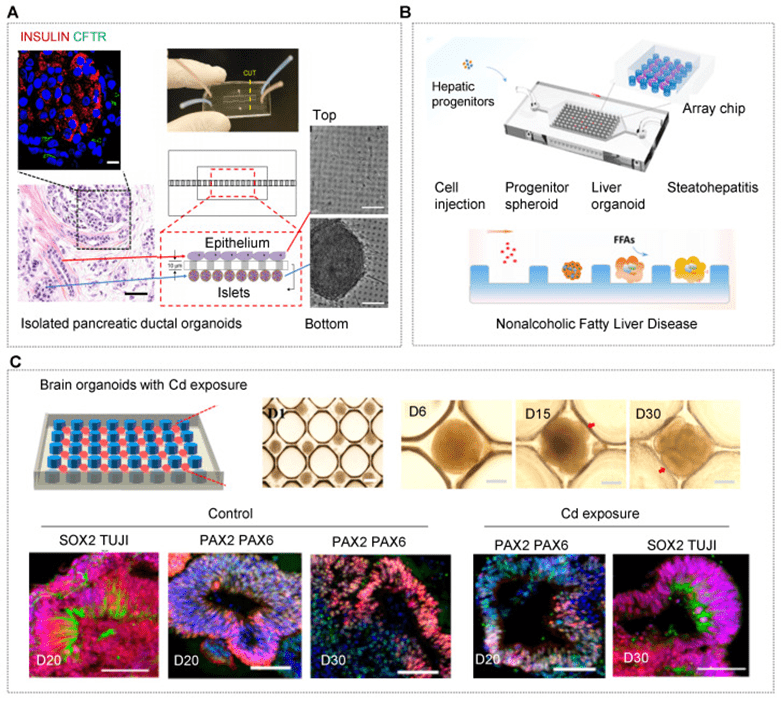
目前已开发多种疾病器官芯片(OrgOC)模型,如囊性纤维化、肝病、热带肠病、炎症、帕金森病和肿瘤转移等,用于揭示发病机制、疾病靶点和表观遗传调控。
随着 CRISPR/Cas、RNAi 等基因工具的应用,研究者可利用健康或患者来源的细胞,通过基因编辑或致病诱导构建同源疾病模型,特别是在癌症、遗传病和代谢病中表现突出。
b) 无机污染物暴露
大气污染物(如化学物质、纳米颗粒和颗粒物)暴露对人体健康构成严重威胁,OrgOC 模型为深入研究其致病机制和器官生物效应提供了新平台。
研究表明,产前暴露于镉、尼古丁、酒精等环境因子可导致脑类器官发育异常和持久性神经毒性。
为模拟吸烟引发的慢性阻塞性肺病(COPD),研究人员建立了动态微流控系统,发现其可重现患者中观察到的纤毛功能障碍和氧化损伤,揭示关键致病分子 MMP-1 的作用。
c) 病毒感染
临床与动物研究表明,病毒感染可引发多种疾病,如 HIV 可导致神经毒性、情绪障碍等长期不良影响,但由于物种差异,亟需可模拟人类病毒感染病理特征的模型。
器官芯片(OrgOC)因其高度仿生性,已被广泛用于研究病毒感染机制与传播动态,如呼吸道合胞病毒和寨卡病毒感染分别引起的气道损伤和小头畸形。
特别是在新冠疫情中,多项研究通过肺泡芯片、远端肺类器官和肠道芯片模型重现 SARS-CoV-2 的感染过程,揭示病毒可引起肺泡屏障破坏、免疫激活、棒状细胞高感染性及肠道结构与功能损伤。
3) 精准医疗
a) 药代动力学研究
新药研发过程复杂且耗时,传统动物模型与人类生理差异较大,限制了药物筛选的准确性。
器官芯片(OrgOC)作为仿生疾病模型的新兴技术,具备高通量、微型化和精准模拟人类器官功能的优势,可显著提升药物代谢、药效动力学(PK/PD)研究的效率与可靠性。
OrgOC 不仅弥合了动物模型与临床试验间的差距,还可在癌症类器官活体生物库的支持下进行个体化药物筛选。
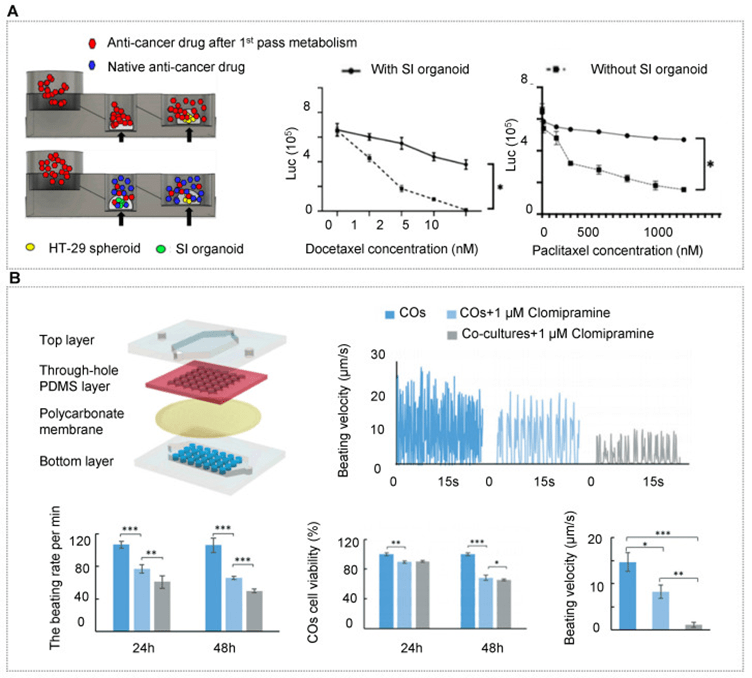
b) 药品安全性评估
药物安全性评估面临挑战,传统临床前模型预测准确性不足,导致新药开发周期长、成本高。
类器官芯片(OrgOC)通过系统模拟多个器官间的相互作用,正革新候选药物的毒性测试。
研究显示,肝-心类器官芯片可揭示氯米帕明等药物的代谢依赖性心脏毒性;多器官芯片模型还可模拟卡培他滨代谢为 5-FU 后对肺和心脏造成损伤,及异环磷酰胺引发的神经毒性。
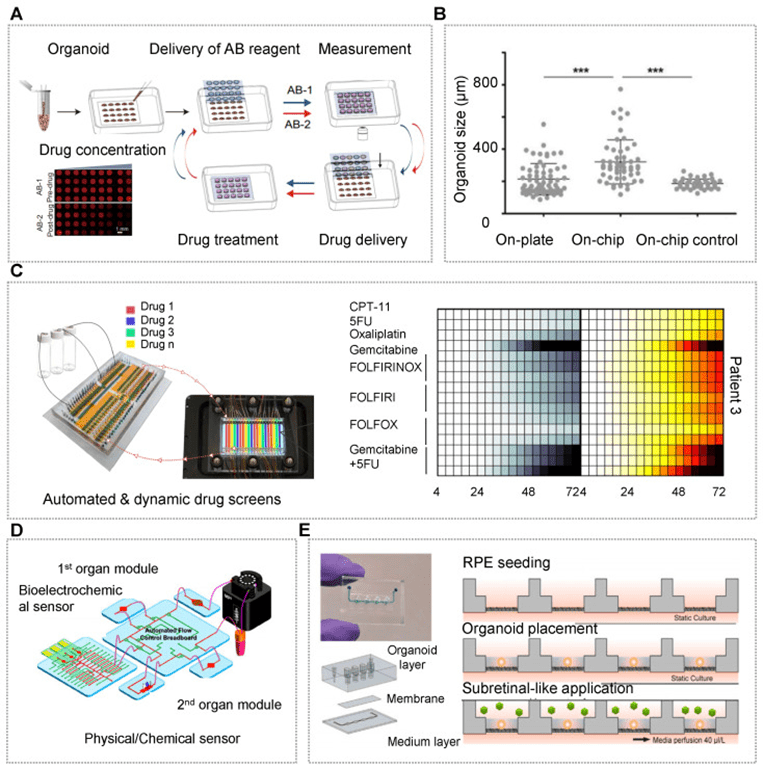
c) 药物筛选
高通量筛选(HTS)技术可自动测试大量候选药物,结合活体类器官生物库将大大提升药物筛选效率。
尤其是肿瘤类器官生物库能更好地保留肿瘤的异质性和突变特征,适用于个性化治疗和临床前模型构建。
当前,多家科研机构已建立患者来源的癌症类器官生物库,如宋教授团队开发的胶质母细胞瘤类器官有效保留肿瘤关键特征,用于模拟免疫疗法反应。
结合二代测序和药敏测试,这些生物库可用于临床决策。
刘等人借助微阵列芯片高效生成肺癌类器官,药敏结果与临床高度一致。
Ai团队利用嵌套阵列芯片开展结直肠癌类器官的HTS,发现瑞戈非尼对某些患者更有效。
参考文献:Human organoids-on-chips for biomedical research and applications – PMC
© 2026. All Rights Reserved. 苏ICP备2022036544号-1













