1. 引言:血管研究的技术瓶颈与微流控突破
血管生物学研究是生物医药领域的核心方向之一,其成果直接关联动脉粥样硬化、癌症转移、糖尿病血管病变等重大疾病的诊疗突破。传统研究依赖孔板培养等常规方法,难以模拟体内血管细胞所处的动态剪切应力、三维 extracellular matrix 微环境及细胞间复杂相互作用,导致实验结果与生理实际存在显著偏差。
近年来,微流控技术的崛起为这一困境提供了革命性解决方案。作为精准操控微尺度流体的跨学科技术,微流控芯片凭借体积小巧、试剂消耗低、环境可控性强等优势,能够高度还原体内血管的生理微环境。其中,PDMS 微流控芯片因其生物相容性佳、透明易观测、加工成本低等特性,成为血管研究的核心载体,而 MEMS 加工、SU8 模具制备、PDMS 键合对准平台等关键技术的成熟,进一步推动了微流控系统在该领域的规模化应用。本文结合前沿研究成果,系统解析微流控技术在血管研究中的核心应用与技术支撑。
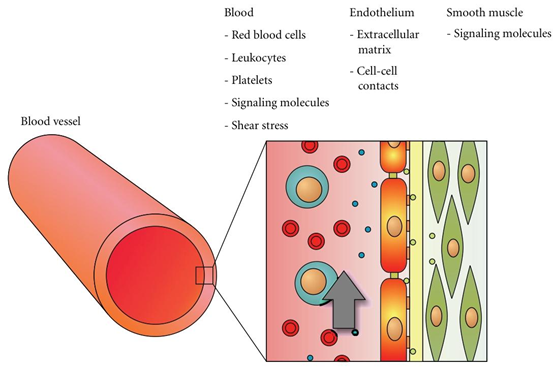
图1:血管和内皮细胞微环境的示意图。血管内壁(左侧)由一层内皮细胞组成,这些细胞嵌入在三维微环境中(右侧)。该环境包含细胞生物学、生物化学和物理刺激,例如分别为红细胞、白细胞、信号分子和剪切应力。在体外模拟这种复杂的微环境是血管研究中的一项重大挑战。
2. 微流控技术核心支撑:PDMS 芯片制备与 MEMS 加工体系
微流控技术的落地离不开成熟的芯片制备与加工工艺,其中 PDMS 微流控芯片的规模化生产是关键环节。其制备过程以软光刻技术为核心,通过 SU8 模具实现微通道结构的精准复刻 —— 将 PDMS 预聚体与交联剂混合后,经 PDMS 浇筑器均匀铺覆于 SU8 模具表面,固化后借助 PDMS 键合对准平台与玻璃或 PDMS 基底通过等离子键合机完成密封,最后通过 PDMS 打孔器开设进出液口,搭配管路系统即可构成完整的微流控装置。
这一制备流程的高效实现,离不开 MEMS 加工平台的技术支撑。从光刻胶涂覆、曝光显影到深硅刻蚀、电子束光刻等工艺,MEMS 加工技术确保了微通道尺寸的微米级精度控制,而表面修饰技术(如氨基修饰、PEG 修饰、亲水修饰)则进一步优化了芯片表面的细胞相容性与流体操控性能。目前,依托微纳加工国家重点实验室等平台,PDMS 芯片加工已实现标准化,从 SU8 模具定制到 PDMS 芯片定制的全流程服务,为血管研究提供了灵活的技术支持。
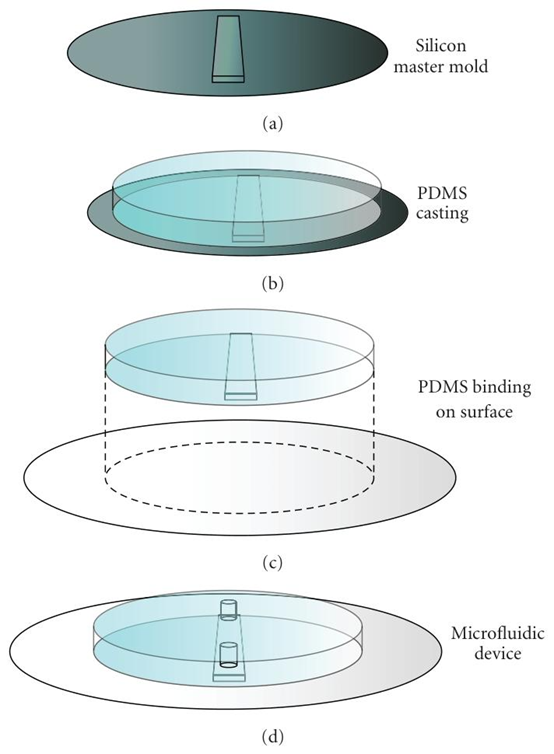
图3:PDMS芯片制造流程示意图。(a)首先制作硅母模——其典型尺寸为直径10厘米、厚度0.5毫米,顶部带有微流控结构。(b)将PDMS低聚物与交联剂的粘性混合物倒在母模顶部,使其形成柔韧的交联网络。(c)将PDMS板从母模上剥离,并与玻璃或PDMS表面结合,以形成封闭的微流控通道。(d)微流控装置准备就绪,可以使用。在与表面结合之前,可以在PDMS板上打孔,以连通所形成的微流控通道。
3. 微流控在血管研究中的关键应用场景
1) 内皮细胞力学响应的精准模拟
血管内皮细胞长期处于血液流动产生的剪切应力环境中,这种力学刺激对维持血管稳态至关重要。传统平行板流动腔需大量试剂且剪切应力均匀性差,而微流控芯片凭借微通道结构优势,仅需低流速(如 Song 等人实验中 < 200μL / 小时)即可产生生理水平的剪切应力(0.01-1Pa),完美模拟体内血管的力学微环境。
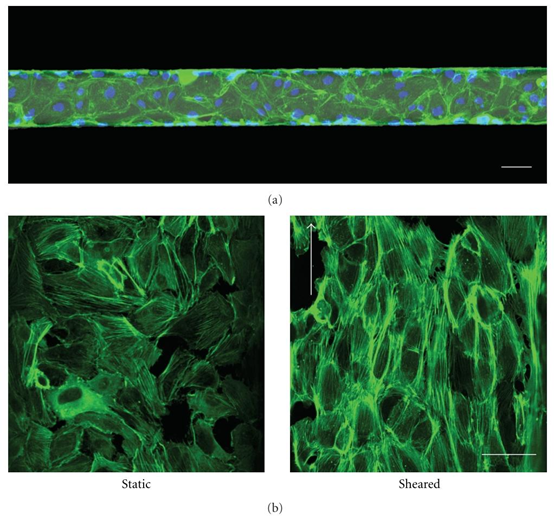
图4:微流控通道中的内皮细胞。(a)人脐静脉内皮细胞在微流控通道中培养。达到汇合状态后,用多聚甲醛固定细胞,并对肌动蛋白丝(绿色)和细胞核(蓝色)进行染色。比例尺为50μm。(b)在微流控通道内承受生理水平剪切应力的内皮细胞会重新调整其肌动蛋白细胞骨架的方向,使其与流体流动方向一致(右侧)。比例尺为50μm。
实验表明,在 PDMS 微流控芯片中,内皮细胞在剪切应力作用下会向血流方向伸长排列, actin 细胞骨架发生定向重组,同时释放一氧化氮等血管活性物质 —— 这一过程可通过荧光成像实时观测。此外,借助微流控芯片的高通量设计,可同时筛选不同药物对内皮细胞力学响应的影响,为抗动脉粥样硬化药物研发提供高效平台。而 PDMS 芯片加工的灵活性,使得研究人员可通过调整通道尺寸与流速,精准调控剪切应力大小,满足不同血管段(如动脉、毛细血管)的模拟需求。
2) 血管细胞迁移的梯度调控与定量分析
细胞迁移是血管新生、伤口愈合及肿瘤转移的核心过程,其受生长因子梯度、基质刚度等多重信号调控。微流控芯片的层流特性的应用,可通过平行流体通道生成稳定的浓度梯度或刚度梯度,为细胞迁移研究提供精准可控的实验环境。
在生长因子梯度研究中,Barkefors 等人通过三通道 PDMS 芯片生成血管内皮生长因子(VEGF)梯度,发现内皮细胞迁移速度与梯度陡峭度正相关,且在 0-50ng/mL 梯度范围内迁移活性最佳。而 Zaari 等人则利用微流控芯片制备刚度梯度凝胶,证实平滑肌细胞具有向高刚度基质迁移的特性。此外,通过在微流控通道中引入胰蛋白酶流,可快速构建人工划痕模型,实现细胞迁移芯片上的伤口愈合实验,该方法已成功应用于内皮细胞与成纤维细胞的迁移定量分析。
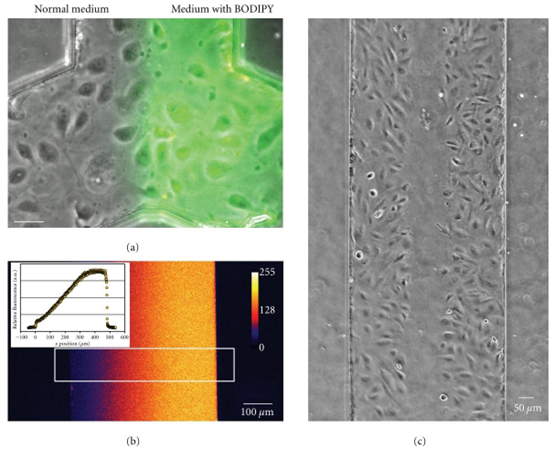
图5:微流控通道内平行流体流动的应用。(a)通过将两种介质泵入两个入口,可以对微流控通道的不同部分进行不同处理。在这种情况下,一种荧光标记被添加到其中一股平行流体流中。流动方向为从下到上;比例尺为50μm。(b)当流速足够低时,介质在通道内停留的时间足以发生扩散。这种现象可用于在通道中产生并维持稳定的梯度。在这种情况下,使用了三股平行的入口流,分别含有0μg/mL、5μg/mL和10μg/mL的葡聚糖-罗丹明。当对通道宽度上的荧光进行量化时,可以观察到近乎线性的梯度(图像中的白色方框,在插图中绘制)。(c)通过使用平行流,通道的中间部分用胰蛋白酶处理。结果,通道中间的内皮细胞被选择性去除,形成人工伤口。可以随时间追踪该伤口的闭合情况,以量化细胞迁移速率。
3) 细胞相互作用的可视化研究平台
血管微环境中,内皮细胞、平滑肌细胞、白细胞、血小板及肿瘤细胞间的相互作用,是炎症反应、血栓形成及癌症转移的关键环节。微流控芯片可通过细胞图案化技术,实现不同细胞类型的精准共培养,为观测细胞间动态相互作用提供了可视化平台。
例如,Song 等人设计的 PDMS 微流控芯片,成功模拟了循环肿瘤细胞与内皮细胞的粘附过程,发现趋化因子 CXCL12 可显著增强乳腺癌细胞与内皮细胞的结合能力,为癌症转移机制研究提供了直接证据。在炎症反应研究中,微流控芯片可重现白细胞在剪切应力下与内皮细胞的滚动、粘附过程,而通过表面修饰技术(如免疫蛋白修饰),可进一步探究粘附分子的作用机制。此外,针对血栓形成研究,微流控芯片可模拟血管损伤微环境,观测血小板激活与聚集的动态过程,为抗血栓药物筛选提供高效模型。
4) 3D 血管培养与器官芯片的构建
三维微环境是血管细胞正常生理功能维持的关键,微流控技术与 hydrogel 材料的结合,实现了 3D 血管结构的体外重建。Vickerman 等人设计的双通道 PDMS 芯片,通过胶原水凝胶填充中间腔室,在生长因子梯度诱导下,内皮细胞从通道向凝胶内迁移并形成贯通的人工毛细血管,这一结构可模拟体内血管的物质交换功能。

图6:覆盖微流控通道的所有表面可形成“人工毛细血管”。人类内皮细胞在PDMS微流控通道中培养,并使其覆盖所有表面。过夜培养后,对细胞进行固定,并通过共聚焦激光扫描显微镜对肌动蛋白丝进行成像。顶部图像是微流控通道的伪彩色俯视图。红线标记的部分用于构建通道的正视图(中间图像)。底部图像是同一通道的等距体积视图。
器官芯片技术的发展进一步拓展了微流控在血管研究中的应用边界。血管器官芯片通过整合内皮细胞、平滑肌细胞及 extracellular matrix,构建出更接近体内真实结构的血管模型,而肝器官芯片、脑器官芯片等多器官集成系统,可用于研究血管疾病对其他器官的影响及药物的跨器官转运。目前,依托器官芯片加工设备与 3D 细胞培养芯片技术,研究人员已实现血管 – 肿瘤、血管 – 肾脏等复杂组织的共培养,为疾病机制研究提供了更全面的模型。
5) 化合物筛选与再生医学应用
微流控技术的高通量特性使其成为化合物筛选的理想平台。在血管相关药物研发中,PDMS 微流控芯片可模拟动态生理环境,筛选影响血管新生、改善内皮功能的药物分子。例如,通过微流控芯片筛选 siRNA 递送载体,可评估不同粒子在剪切应力下的内皮细胞粘附效率,为基因治疗提供优化方案。
在再生医学领域,微流控芯片为干细胞分化与血管组织工程提供了精准调控工具。Figallo 等人开发的 12 孔微生物反应器,通过调控生长因子浓度、灌注速率及细胞接种密度,成功诱导人胚胎干细胞分化为血管细胞。此外,利用可降解材料(如聚甘油 sebacate)制备的微流控芯片,可构建生物可吸收的血管支架,为组织工程血管的临床转化奠定基础。
4. 技术优势与行业发展前景
微流控技术在血管研究中的优势体现在多个维度:其一,试剂消耗量仅为传统方法的千分之一,显著降低了稀有细胞(如原代内皮细胞)与昂贵试剂的使用成本;其二,可同时整合剪切应力、浓度梯度、细胞共培养等多重生理因素,实现对体内微环境的精准模拟;其三,兼容荧光显微镜、流式细胞仪等常规分析设备,便于实时观测细胞动态行为。
从行业发展来看,微流控技术正朝着自动化、高通量、多器官集成的方向演进。随着 MEMS 代加工、PDMS 芯片定制等产业链的成熟,微流控芯片的生产成本持续降低,推动了其在科研与临床领域的规模化应用。未来,结合人工智能与大数据分析,微流控系统将实现血管疾病的精准预测与个性化药物筛选,而生物可降解微流控芯片与 3D 生物打印技术的结合,有望实现组织工程血管的临床转化。
5. 结语
微流控技术以 PDMS 微流控芯片为核心载体,凭借 MEMS 加工、表面修饰、器官芯片等关键技术支撑,彻底改变了血管生物学研究的范式。从内皮细胞力学响应到 3D 血管网络构建,从细胞相互作用观测到高通量药物筛选,微流控系统通过精准模拟体内生理微环境,为血管疾病机制研究与诊疗技术开发提供了强大工具。
随着自动化与高通量技术的不断突破,微流控技术将在血管研究中发挥更大作用,推动动脉粥样硬化、癌症转移等重大疾病的诊疗突破。未来,微流控芯片与再生医学、人工智能的深度融合,将开启血管研究的精准化、个性化新时代,为人类健康提供更坚实的技术保障。
参考文献:doi:10.1155/2009/823148
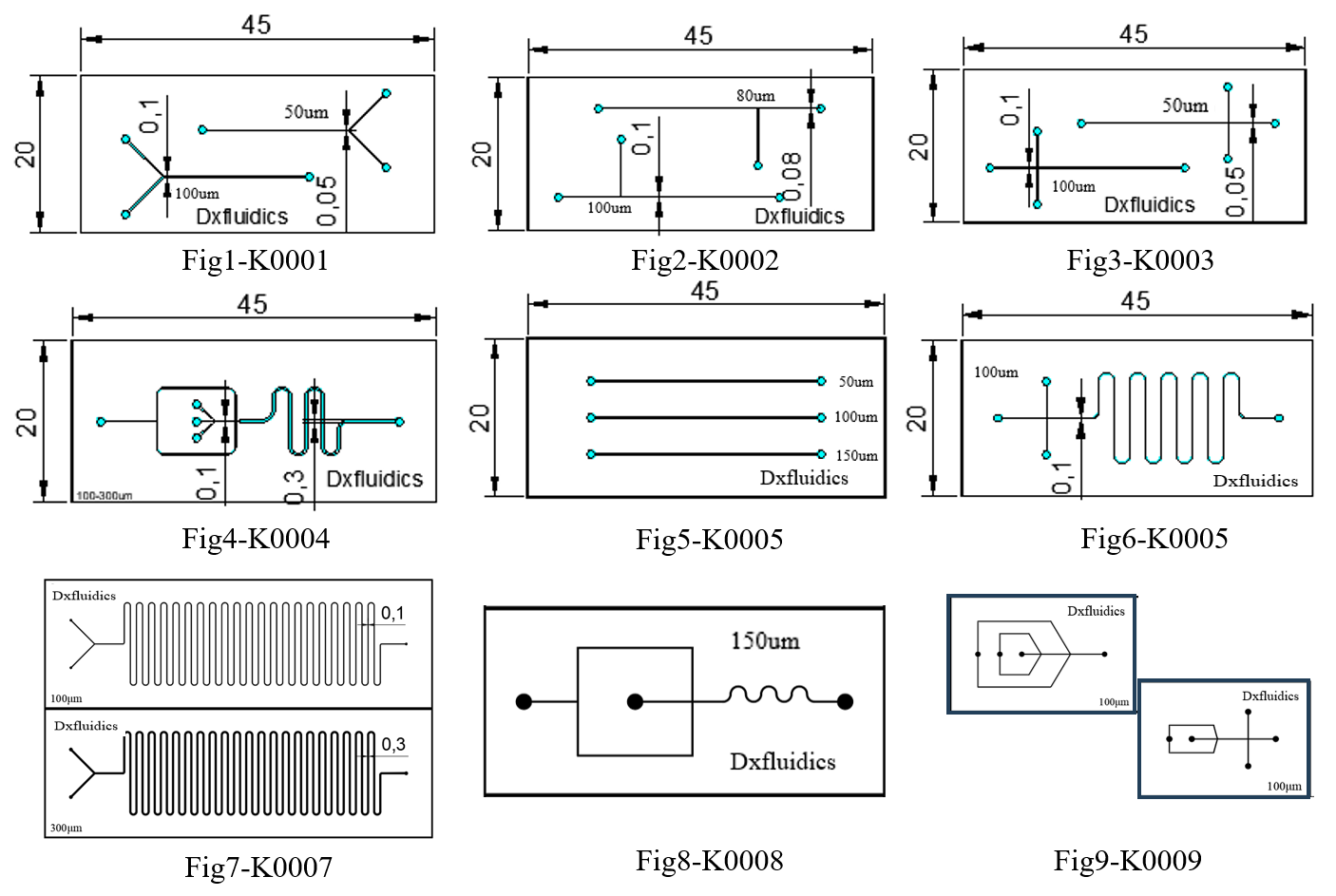
Dxfluidics product ( standard PDMS chip)
Our company also provides customized microfluidic PDMS chip processing services. For specific details, please feel free to contact us at +86-17751163890 (also available on WeChat) or email:sale@dxfluidics.com.
| Product Code | Outline (mm) | Height (um) | Width (um) | Thickness (mm) | Chip material | Price (CNY) |
| K0001 | 45*20 | 50 | 50&100 | 3+1 | PDMS+Glass | 300 |
| K0002 | 45*20 | 50 | 80&100 | 3+1 | PDMS+Glass | 300 |
| K0003 | 45*20 | 50 | 50&100 | 3+1 | PDMS+Glass | 300 |
| K0004 | 45*20 | 50 | 100&300 | 3+1 | PDMS+Glass | 300 |
| K0005 | 45*20 | 50 | 50&100&150 | 3+1 | PDMS+Glass | 300 |
| K0006 | 45*20 | 50 | 100 | 3+1 | PDMS+Glass | 300 |
| K0007 | 75*25 | 100 | 100&300 | 3+1 | PDMS+Glass | 300 |
| K0008 | 52*25 | 100 | 100&150&200 | 3+1 | PDMS+Glass | 300 |
| K0009 | 35*24 | 100 | 100&200 | 3+1 | PDMS+Glass | 300 |
Ordering Methods



© 2026. All Rights Reserved. 苏ICP备2022036544号-1












