在生物医学与微机电系统(MEMS)加工技术快速发展的背景下,微流控芯片与器官芯片的融合应用成为细胞代谢监测的核心方向。氧作为细胞呼吸与能量产生的关键物质,其浓度精准检测直接影响细胞培养、药物筛选及疾病模拟的可靠性。基于微流控技术的氧传感器,凭借微型化、高灵敏度、实时监测等优势,已成为 3D 细胞培养芯片、类器官芯片等高端生物芯片的核心组件。本文结合最新研究成果,系统解析光学与电化学两类微流控氧传感器的技术突破,融合 PDMS 芯片加工、MEMS 加工、光刻等核心工艺,探讨其在器官芯片领域的应用与未来趋势。
1. 技术背景:微流控与氧传感的协同创新
细胞代谢过程中,氧浓度直接决定 ATP 生成路径 —— 有氧环境下的高效呼吸与缺氧状态下的糖酵解,均需精准量化以评估细胞活力。传统氧检测方法难以适配微流控芯片的微型化、低样本量需求,而微流控技术的出现实现了流体的精准操控,结合 MEMS 加工工艺的高精度优势,使芯片级氧传感器的集成成为可能。
当前,微流控氧传感器已广泛应用于 PDMS 芯片、PMMA 芯片、COC 芯片等不同材质的生物芯片中,通过与器官芯片加工设备、3D 细胞培养芯片的深度融合,为肝器官芯片、脑器官芯片、血管器官芯片等场景提供实时氧浓度数据。其核心价值在于实现非侵入式监测,避免干扰细胞微环境,同时兼容微流控芯片定制化需求,适配从单细胞分析到多器官联动的复杂场景。
2. 光学氧传感器:高灵敏度与多场景适配的核心选择
光学氧传感器凭借非侵入、无氧消耗、易集成等优势,成为微流控芯片的主流选择,其技术发展围绕发光机制优化、材料创新及设备小型化展开,深度融合微流控芯片加工工艺。
1) 基础发光型传感器:工艺简化与稳定性提升
基础发光型传感器基于氧分子对荧光 / 磷光染料的猝灭效应,核心材料包括 PtTFPP、PtOEP 等金属卟啉类染料。这类传感器通过光刻胶模具制备技术,将染料与 PDMS、COC 等聚合物融合,形成传感层集成于芯片通道内。例如,PDMS 芯片通过溶剂诱导荧光浸渍法(SIFI)实现染料均匀负载,避免了传统涂层易脱落、开裂的问题,同时兼容 MEMS 加工中的光刻、键合工艺,使传感器与芯片结构无缝衔接。在肝器官芯片应用中,PtOEP 染料修饰的 PDMS 芯片可实现宽动态范围的氧梯度监测,适配不同流速下的细胞培养需求。
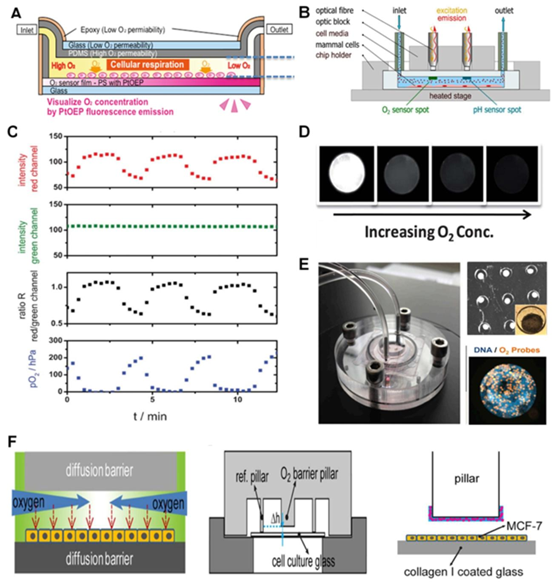
图1. 基于基础发光的传感器和基于微技术的O₂发光传感器 图1. 基于基础发光的传感器和基于微技术的\(O_{2}\)发光传感器 (A)芯片研究中O₂监测集成层的概念。(A)用于肝脏研究的设备中\(O_{2}\)敏感染料集成层的概念。经许可转载[42],版权所有2019,约翰·威利父子公司。(B)用于肝脏研究的器官芯片设备。经许可转载[42],版权所有2019,约翰·威利父子公司。基于光纤的O₂检测(B)基于光纤的\(O_{2}\)和pH检测。经许可转载[43],版权所有2021,爱思唯尔。(C)通过比较\(O_{2}\)敏感染料与非\(O_{2}\)敏感染料的信号作为参考进行光学\(O_{2}\)检测的比率概念。经许可转载[61],版权所有2013,英国皇家化学会。(D)使用微流体技术合成了含有发光染料的PDMS微珠,用于O₂传感。它们在O₂梯度(不同浓度的\(O_{2}\))中的性能如图所示。经许可转载[68],版权所有2012,英国皇家化学会。(E)一种生物反应器(肝芯片)设备(左),用于分析药物对HepG2/C3A类器官线粒体活性的影响。每个微孔都包含一个类器官(右上),以及用于基于成像的O₂传感的集成有发光体的微粒(右)。经许可转载[69],版权所有2016,美国国家科学院。(F)微生物反应器(右下)结构内部的\(O_{2}\)梯度(左)以及带有\(O_{2}\)传感微珠(粉圈)的\(O_{2}\)屏障和传感柱(右)。经许可转载[45],版权所有2017,施普林格·自然。
2) 微粒与纳米增强技术:性能突破的关键路径
微粒基传感器通过将发光染料负载于聚苯乙烯微球、硅微珠等载体,提升了染料稳定性与传感灵敏度。在肿瘤芯片中,硅微珠负载 Ru (dpp) 染料的 PDMS 芯片,实现了缺氧微环境的空间分辨监测,其加工过程结合了 SU8 模具制备与微流控芯片对准技术,确保微粒在通道内的均匀分布。纳米增强技术则进一步推动性能升级,核心壳结构的聚合物纳米颗粒(如聚苯乙烯 – 聚乙烯吡咯烷酮纳米珠)不仅提升染料溶解度,还能避免生物分子干扰,适配细菌培养、干细胞监测等场景。这类纳米传感器的制备依赖 MEMS 加工中的电子束光刻与表面修饰技术,通过氨基修饰、PEG 修饰等表面功能化处理,增强生物相容性。
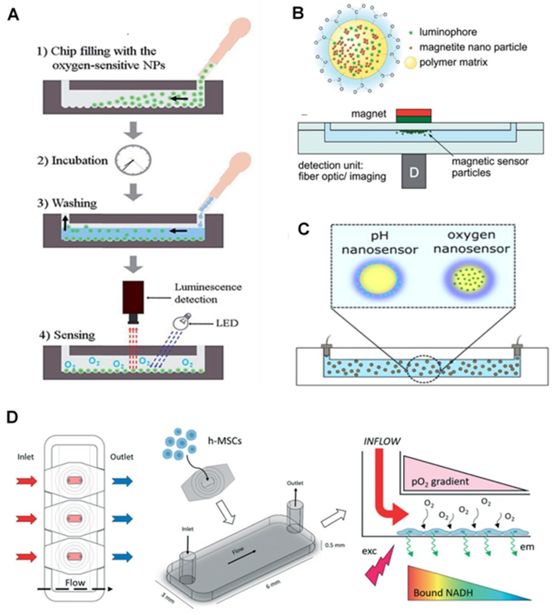
图2. 纳米颗粒在芯片上传感器中的应用。(A)将纳米颗粒引入通道,使其附着在芯片内的微珠上,形成\(O_{2}\)敏感层。发光体在芯片内与外部磁铁位置平行的一个点上聚集。经许可转载[51],版权所有2015,英国皇家化学会。(B)带有发光体的磁性纳米颗粒在芯片内与外部磁铁位置平行的一个点上聚集。经许可转载[76],版权所有2014,英国皇家化学会。(C)核壳纳米颗粒中的敏感染料,用于同时检测O2和pH值。经许可转载[76],版权所有2014,英国皇家化学会。(D)基于芯片的干细胞培养,通过光学发光传感层监测\(O_{2}\)梯度。经许可转载[48],版权所有2021,英国皇家化学会。
3) 商用化与便携设备:落地应用的重要支撑
商用光学传感器模块的普及加速了技术落地,FireStingO2、Piccolo2 等 USB 接口设备可直接与微流控芯片的传感位点连接,支持实时数据传输。在斑马鱼胚胎培养芯片中,PMMA 芯片集成的氧传感箔片与 VisiSens 便携式探测器配合,实现了 28 天连续氧浓度监测,无需频繁校准。这类设备的核心优势在于兼容不同材质芯片(玻璃、PDMS、PMMA),且适配微流控芯片定制化需求,可根据细胞培养芯片的通道设计调整传感位点布局。

图3. 用于芯片上\(O_{2}\)监测的商用和便携式光学读出系统。(A) 一款芯片(左),专为商用光学读出设备(右)设计。经许可转载,版权所有2016,爱思唯尔。(B) 基于芯片的细菌研究,通过(左)为商用光学读出设备(右)设计的壁进行氧气测量。经许可转载[78],版权所有2016,爱思唯尔。(B) 基于芯片的细菌研究,通过使用商用读出设备的管壁进行\(O_{2}\)测量。经许可转载[49],版权所有2016,美国化学会。(C) 一款便携式手持光电探测器设备,连接到移动应用程序,用于基于芯片的氧气监测。经许可转载[80],版权所有2021,MDPI。美国化学会。(C) 一款便携式手持光电探测器设备,连接到移动应用程序,用于基于芯片的\(O_{2}\)监测。经许可转载[80],版权所有2021,MDPI。
3. 电化学氧传感器:快速响应与极端环境适配能力
电化学氧传感器以高灵敏度、短响应时间为核心优势,通过结构优化与材料创新,克服了传统侵入式检测的弊端,在动态流场、低氧环境等场景中展现独特价值,其加工工艺深度依赖 MEMS 加工中的阳极键合、深硅刻蚀等技术。
1) Clark 型传感器的结构革新
Clark 型传感器是电化学氧检测的经典方案,通过改进结构设计降低氧消耗。低温柔性陶瓷(LTCC)基 Clark 型传感器采用 Nafion 质子传导膜作为支撑,结合 PDMS 透气膜,避免了薄膜机械失效问题,响应时间缩短至 10.9 秒,适配器官芯片的实时监测需求。此外,基于 Ross 原理的零消耗 Clark 传感器,通过工作电极与对电极的协同作用,补偿氧消耗,实现长期稳定监测,其加工过程融合了微流控芯片的 PDMS 键合与阳极键合技术,确保电极与芯片通道的精准集成。
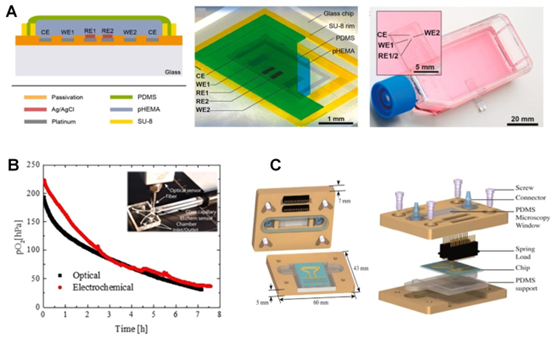
图4. 用于芯片上氧气测量的电化学传感器。(A) 克拉克型氧气监测微传感器的横截面和俯视图,该传感器通过计时电流法传感协议应用于细胞培养和器官芯片系统。经许可转载[85],版权所有2020,爱思唯尔。(B) 微流控细胞培养芯片,通过通道内并行电化学和光学氧气测量,使用商用光学和电化学读出设备,结果(红色和黑色曲线)具有一致性。经许可转载[105],版权所有2019,美国化学会。(C) 微流控芯片的组件和横截面,该芯片带有电化学检测电极阵列,包括一组独特的三电极(用于氧气、钾)以及用于葡萄糖、乳酸和pH测量的电极阵列。经许可转载[106],版权所有2015,爱思唯尔。
2) 新型材料与加工工艺的融合
材料创新是电化学传感器性能提升的核心,PDMS、Nafion、聚苯胺(PPy)等材料的应用优化了传感器的生物相容性与稳定性。例如,Nafion 修饰的金电极在 PDMS 生物芯片中实现了动态流场下的氧浓度监测,灵敏度达 0.5 nA・mol⁻¹・L⁻¹,且兼容 3D 细胞培养的动态环境。加工工艺方面,喷墨打印(IJP)技术实现了传感器在多孔膜上的直接制备,在肝器官芯片中,喷墨打印的氧传感器可实时监测肝细胞代谢导致的氧梯度变化,其低氧消耗特性避免了影响细胞活力。此外,3D 打印技术的应用简化了传感器结构设计,使多电极阵列的集成更高效,适配微流控芯片定制化的复杂布局需求。
3) 纳米材料的性能增强作用
纳米材料的引入显著提升了电化学传感器的灵敏度与响应速度。Nafion 包裹的铂纳米颗粒修饰电极,通过增大比表面积,使传感器检测限低至 0.49 nAs⁻⁰.⁵/mg/L,响应时间小于 5 毫秒,适用于微组织呼吸活性的原位评估。在血管器官芯片中,这类纳米增强传感器可监测血管内皮细胞在不同氧浓度下的功能变化,其加工过程结合了 MEMS 加工的电子束光刻与表面修饰技术,确保纳米材料与电极的稳固结合。
4. 核心应用场景与加工工艺协同发展
微流控氧传感器的价值实现,离不开与芯片加工工艺、应用场景的深度协同,核心关键词如 MEMS 加工、光刻、PDMS 芯片键合、器官芯片加工设备等,贯穿于技术研发与落地全流程。
1) 细胞与类器官培养监测
在 3D 细胞培养芯片中,氧传感器可实时追踪干细胞、肿瘤细胞的代谢状态。例如,聚苯乙烯微球负载 Pt-porphyrin 染料的 PMMA 芯片,实现了斑马鱼胚胎培养中氧消耗率与酸化率的同步监测,加工过程采用光刻胶模具制备与 PDMS 浇筑技术,确保芯片密封性与生物相容性。在类器官芯片中,传感器与 COC 芯片的集成的 COC 芯片的集成,适配肺器官芯片、肾器官芯片的长期培养需求,通过微流控芯片的梯度生成功能,模拟体内氧浓度分布,为药物毒性评估提供精准数据。
2) 芯片加工工艺的集成优化
微流控氧传感器的集成依赖成熟的芯片加工工艺,MEMS 加工中的光刻、深硅刻蚀、阳极键合技术,确保了传感器电极与芯片通道的精准对齐。PDMS 芯片的加工过程中,通过 SU8 模具制备、PDMS 键合对准平台实现传感层与流体通道的无缝贴合,避免漏液与氧泄漏。表面修饰技术(如环氧基修饰、氨基修饰)则提升了传感器与芯片表面的结合力,延长使用寿命。此外,微流控芯片定制服务可根据不同应用场景,调整传感器类型(光学 / 电化学)、布局与检测范围,适配从基础研究到临床前检测的多样化需求。
3) 肿瘤与疾病模型应用
在肿瘤芯片中,氧传感器模拟肿瘤微环境的缺氧梯度,为癌症代谢研究与药物筛选提供支撑。例如,硅胶微粒负载发光染料的 PDMS 芯片,在 MCF-7 细胞培养中实现了缺氧区域的空间分辨监测,结合微流控芯片的流体操控功能,可精准调控氧浓度梯度。这类芯片的加工融合了 MEMS 加工的微流道加工与表面修饰技术,通过疏水修饰、亲水修饰优化细胞黏附与流体流动特性,提升监测准确性。
5. 未来发展趋势:技术融合与场景拓展
微流控氧传感器的未来发展将聚焦于性能提升、成本降低与多参数集成,核心趋势包括材料创新、工艺简化与智能检测,同时深度结合 3D 打印、AI 等新兴技术。
材料方面,石墨烯、量子点等新型纳米材料将进一步提升传感器灵敏度与稳定性,量子点的宽激发光谱与尺寸可调特性,适配多参数同步监测(如氧、pH、代谢物)。工艺方面,3D 打印微流控芯片技术将简化传感器集成流程,SU8 模具与 PDMS 芯片的快速制备工艺将降低定制成本,使微流控芯片代工服务更具规模化优势。智能检测方面,智能手机与传感器的联动将实现数据实时分析,AI 算法优化信号处理,提升低氧浓度下的检测精度。
应用场景将从单一器官芯片拓展至多器官芯片联动,通过微流控芯片的流体互联,实现肝 – 肠、脑 – 血管等多器官的氧代谢协同监测。同时,传感器将更适配临床需求,在创伤性脑损伤监测、肿瘤精准治疗等场景中实现微创检测,推动微流控技术从实验室走向临床。
微流控氧传感器作为器官芯片、3D 细胞培养芯片的核心组件,其技术发展与 MEMS 加工、PDMS 芯片制备、表面修饰等工艺深度绑定,光学与电化学两类技术的创新突破,为细胞代谢监测提供了多样化解决方案。未来,随着材料科学、人工智能与微流控技术的深度融合,微流控氧传感器将在精准医疗、药物研发等领域发挥更大价值,推动生物芯片技术实现从 “模拟” 到 “预测” 的跨越,成为生命科学研究的核心支撑工具。
参考文献:https://doi.org/10.3390/ bios12010006
Dxfluidics Products
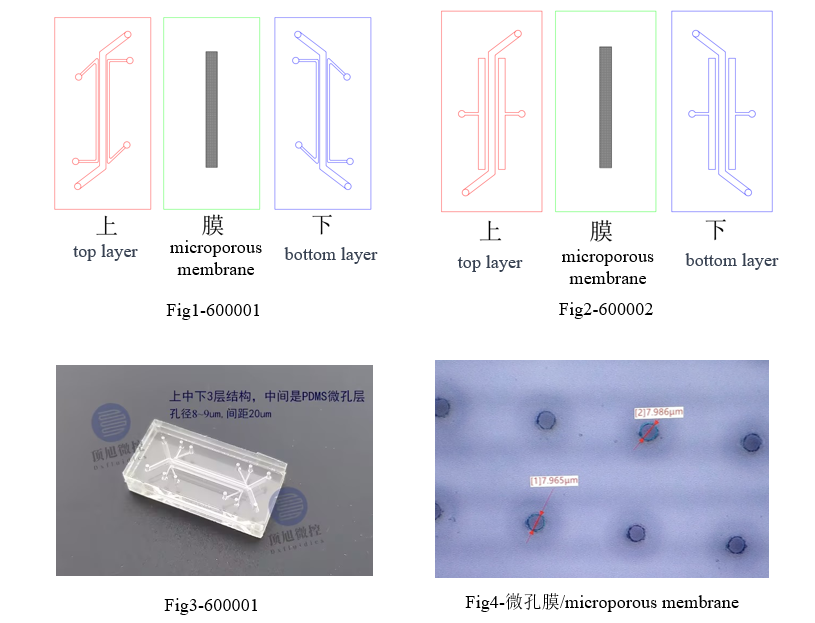
| Product Code | Outline (mm) | Channel | Microporous membrane | Material | Price (CNY) | |||
| Height (mm) | Width (mm) | Space (mm) | Thickness (um) | Hole diameter (um) | ||||
| 600001 | 30*15 | 0.5 | 1 | 0.2 | 25 | 8 | PDMS | 800 |
| 600002 | 30*15 | 0.5 | 1 | 0.5 | 25 | 8 | PDMS | 800 |
Ordering Methods



© 2025. All Rights Reserved. 苏ICP备2022036544号-1












