本文聚焦硫醇 – 烯微流体芯片在氢氘交换质谱(HDX-MS)分析中的创新应用与技术突破。在微流控技术领域,材料特性直接决定芯片性能,传统微流控芯片(玻璃、PDMS)存在加工复杂、溶剂抗性差等局限,而本文开发的硫醇 – 烯微流体芯片(HDXchip),通过两步复制成型工艺,显著突破传统材料瓶颈,为 HDX-MS 分析提供高性能平台。
参考文献:https://doi.org/10.1021/acs.analchem.4c06230
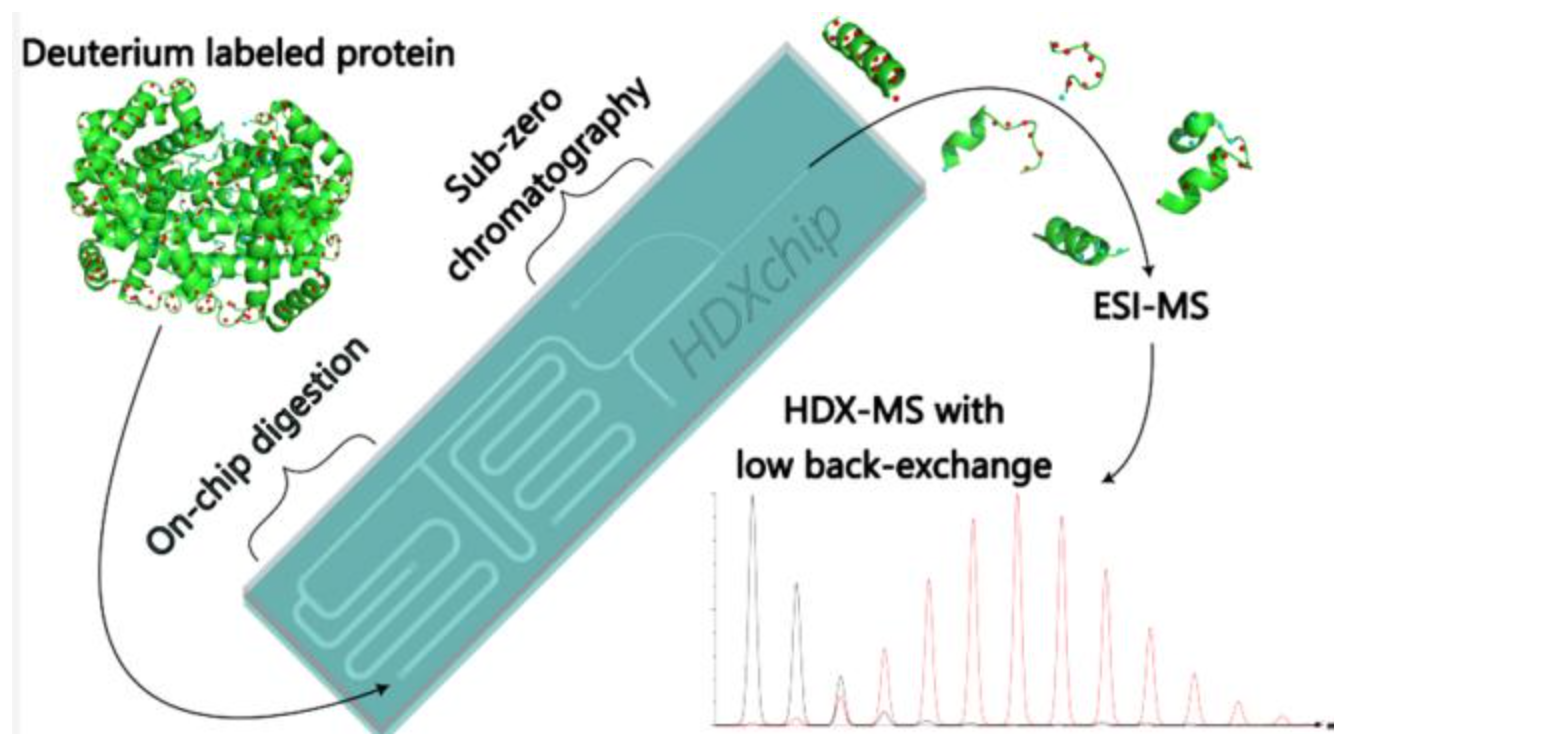
1. 微流体芯片的材料选择与加工创新
材料选择与加工创新:“硫醇 – 烯微流体芯片采用硫醇 – 烯聚合物制备,解决传统芯片局限,其紫外固化与热处理工艺,让硫醇 – 烯微流体芯片具备优异机械强度,适配氢氘交换质谱(HDX-MS)反复冷却需求。”
在微流控技术领域,材料特性直接决定芯片性能。传统微流体芯片多采用玻璃、PDMS (polydimethylsiloxane)等材料,但存在明显局限:玻璃加工依赖湿法蚀刻,工序复杂且成本高昂;PDMS 虽通过软光刻实现快速成型,却因低溶剂抗性和批量生产兼容性差,难以满足高精度分析需求。本文开发的 HDXchip 采用硫醇 – 烯聚合物,通过两步复制成型工艺制备,显著突破了传统材料的瓶颈。
硫醇 – 烯材料的优势体现在多方面:其一,通过紫外固化与热处理(200℃下 16 小时),芯片具备优异的机械强度和化学稳定性,可耐受甲醇等有机溶剂,解决了 PDMS 在有机相环境中易溶胀的问题;其二,材料生物相容性良好,适合固定化酶等生物活性组件的集成;其三,制造过程兼容注塑成型等批量生产工艺,较 PDMS 的手工操作更易实现规模化制备。这种材料创新与 MEMS(微机电系统)加工技术中的精密成型理念相契合,为微流控芯片的低成本、高性能应用奠定了基础。
芯片加工过程融合了多种微制造技术:首先通过计算机辅助设计(CAD)与微铣削制备 PMMA 母模,再以 PDMS 复制模为中间体,实现硫醇 – 烯材料的紫外固化成型。芯片通道的关键结构(如用于固定色谱填料的坝体)通过精密尺寸控制实现 “无筛板填充”,这一设计借鉴了微流控芯片中常见的 “坝体结构” 加工思路,减少了死体积并提高了流体稳定性。与传统光刻技术制备的玻璃芯片相比,该工艺无需复杂的掩膜设计,加工周期缩短至数天,且热处理后的硫醇 – 烯芯片在低温环境下不易分层,满足了 HDX-MS 分析中反复冷却的严苛要求。
2. 多功能集成的芯片架构设计
多功能集成架构设计:“硫醇 – 烯微流体芯片的核心优势,是将氢氘交换质谱(HDX-MS)关键步骤集成,19μL 样品环、固定化酶整体柱等模块,让硫醇 – 烯微流体芯片实现全流程自动化。”
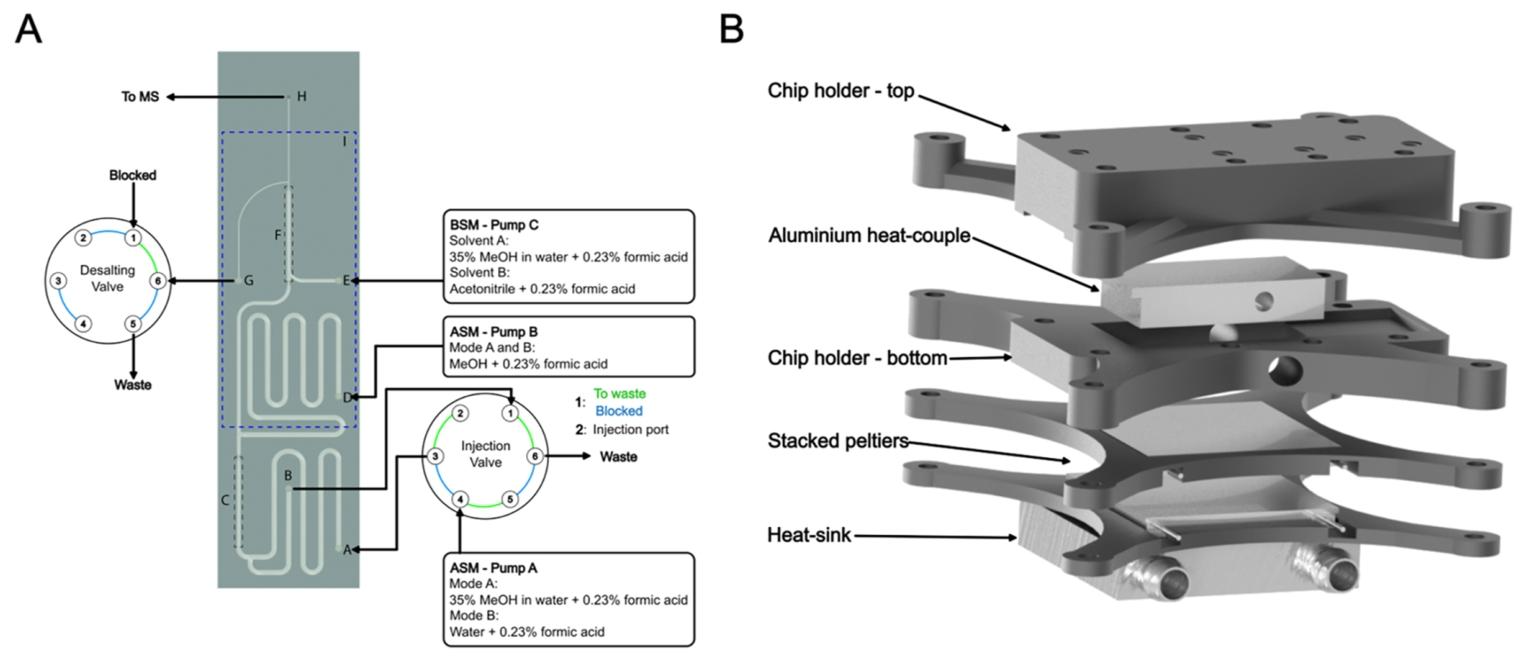
铝热偶、帕尔贴模块和液基散热器。 HDX芯片及装置示意图。(A) HDX芯片包含一个样品环、固定有胃蛋白酶的整体柱以及一个用于反相固定相的隔室。进样阀上的绿色和红色线条分别标记加载和进样位置。(AA) 样品环入口和自动进样器流动相(ASM)入口。(AB) 样品环出口。(AC) 用于原位形成固定胃蛋白酶的整体柱的芯片区域。(AD) 用于甲醇的自动进样器流动相入口。(AE) 缓冲液流动相(BSM)入口。(AF) 用于反相固定相的芯片区域。(AG) 连接到阀的脱盐出口。(AH) 质谱仪出口,(AI) 虚线表示芯片与铝热偶接触的部分。(B) 3D打印芯片支架(黑色)的渲染图。
HDXchip 的核心优势在于将传统 HDX-MS workflow 的关键步骤集成于微尺度平台,实现了 “样品加载 – 酶解 – 分离 – 检测” 的全流程自动化。芯片架构包含三大功能模块:19μL 样品环用于精确计量,固定化胃蛋白酶的整体柱(IMER)实现在线酶解,14mm 反相色谱柱(填充 C18 颗粒)完成脱盐与分离。这种集成化设计大幅缩减了样品传输路径,与微流控技术中 “芯片实验室”(Lab-on-a-Chip)的理念一致,有效降低了死体积和样品损耗。
固定化酶微反应器(IMER)的制备是技术亮点之一。通过在芯片通道内原位聚合硫醇 – 烯整体柱,引入胺基官能团后共价固定胃蛋白酶,解决了游离酶在低温下活性低的问题。对比传统 PDMS 芯片中物理吸附固定酶的方式,这种化学固定法显著提升了酶的稳定性,虽仍存在数天内活性衰减的问题,但可通过填充胃蛋白酶琼脂糖微球实现更长寿命,为后续产业化应用提供了替代方案。这种设计与微流控芯片中 “功能化表面修饰” 技术相通,通过表面化学调控实现生物分子的高效固定。
色谱分离模块采用 10μm C18 颗粒无筛板填充,借助通道末端的尺寸收缩形成 “坝体” 结构,利用 “拱顶效应” 截留填料。该设计避免了传统烧结筛板带来的死体积问题,与微流控芯片中 “微柱阵列”“色谱分离” 等技术思路一脉相承。实验表明,血红蛋白酶解肽段在 4.5 分钟内实现分离,峰宽半高宽仅 41 秒,虽峰容量(4.5)低于专用 UPLC 系统(26.7),但通过离子淌度质谱辅助可提升序列覆盖率至 97.2%,证明了微流控分离在复杂样品分析中的可行性。
3. 低温控制技术与反向交换抑制
低温控制技术:“为降低氢氘交换质谱(HDX-MS)的反向交换率,硫醇 – 烯微流体芯片通过珀尔帖模块实现 – 20℃控温,较传统系统优势显著,凸显硫醇 – 烯微流体芯片在 HDX-MS 中的精准调控能力。”
氢氘交换(HDX)分析中,氘标记的反向交换是制约结果准确性的关键因素。传统 UPLC 系统虽通过 0℃冷却控制反向交换,但仍存在 30-50% 的标记损失;而 HDXchip 通过珀尔帖(Peltier)模块实现 – 20℃亚零温度控制,结合优化的流动相体系(含 50% 甲醇作为抗冻剂),将反向交换率降至 – 7.4% 至 25.4%,显著优于现有技术。这种低温控制策略与微流控芯片 “局部精准温控” 的特点密切相关 —— 芯片小热容量特性使冷却响应时间缩短至 10 分钟内,远快于传统色谱柱的整体冷却模式。
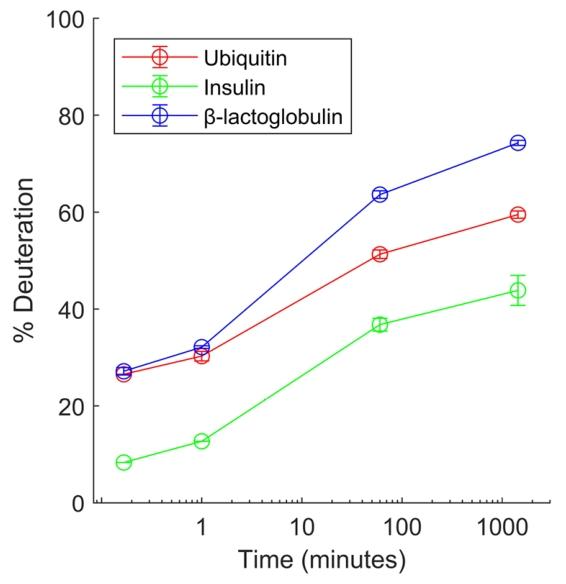
胰岛素、泛素和β-乳球蛋白的全局氢氘交换质谱(HDX-MS)分析。HDX图谱显示了三种不同蛋白质的相对氘化情况及标准差(\((n=3)\) 。
温度校准与系统集成是技术难点。通过在芯片通道内植入 80μm 热电偶,建立了铝制热耦合器温度与通道内实际温度的校正曲线,确保 – 30℃至室温的精准调控。冷却系统采用堆叠式珀尔帖元件与液体散热装置,解决了微流控芯片与宏观设备的热匹配问题,这一设计可推广至其他需要精准温控的微流控应用场景,如 PCR 芯片的热循环控制或酶反应动力学研究。
抗冻剂的选择体现了微流控系统中 “流动相 – 材料 – 分离效率” 的协同优化。50% 甲醇的添加不仅降低了溶液冰点,还与硫醇 – 烯材料的高溶剂抗性兼容,避免了 PDMS 芯片在高有机相下的溶胀问题。实验表明,该体系下肽段保留行为稳定,离子抑制效应可控,为亚零温度下的微流控色谱分离提供了可行方案。
4. 性能验证与生物分析应用
性能验证:“在氢氘交换质谱(HDX-MS)性能测试中,硫醇 – 烯微流体芯片对血红蛋白分析覆盖率达 97.2%,连续运行 200 次无损坏,证明硫醇 – 烯微流体芯片适配 HDX-MS 常规分析。”
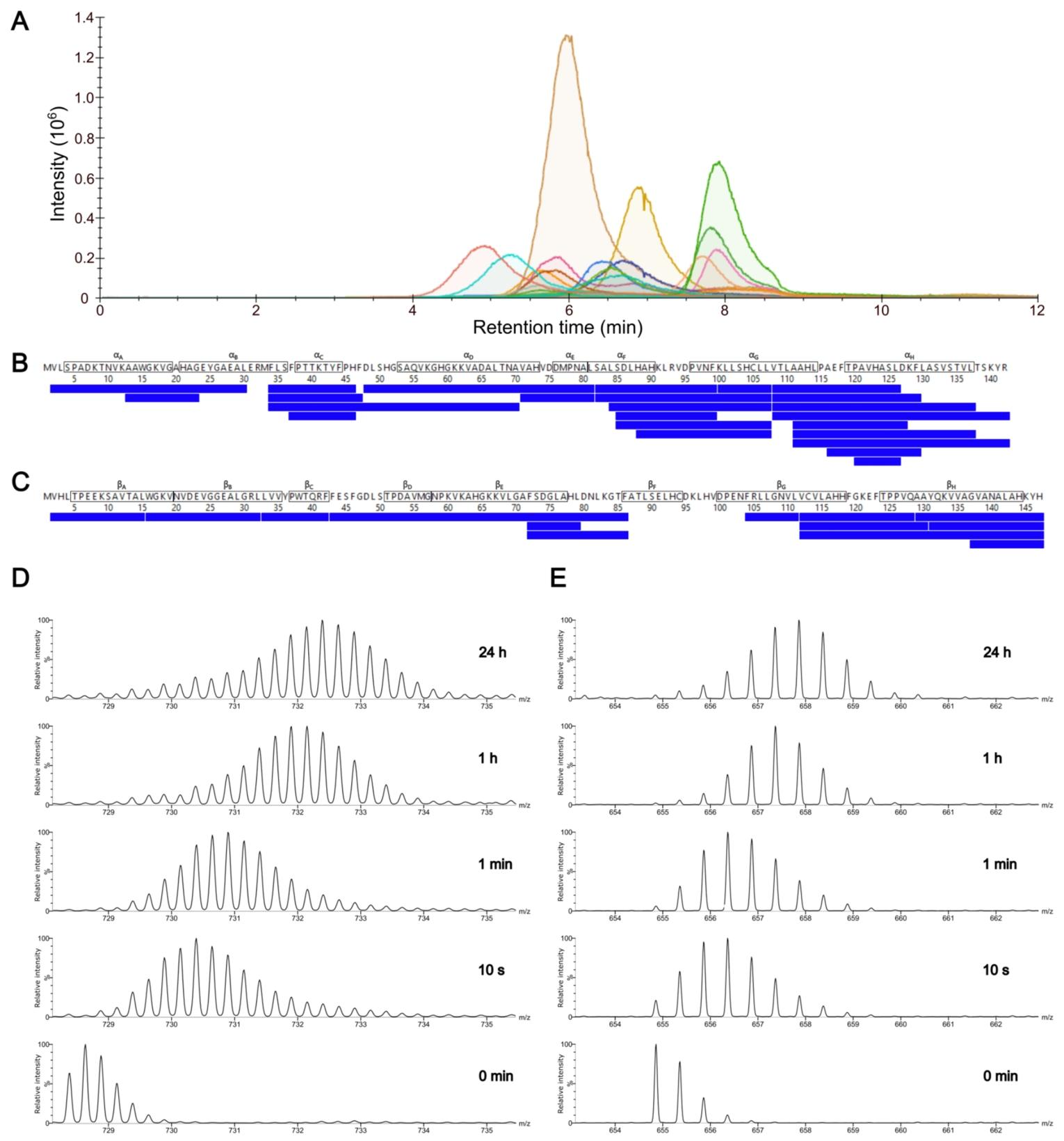
通过HDX芯片对血红蛋白进行局部氢氘交换质谱(HDX-MS)分析。(A) 来自\(Hba\)的分析胃蛋白酶肽的组合提取离子色谱图。(B) 来自\(Hb_{a}\)的整理后的HDX-MS数据覆盖图(24个肽段,覆盖率97.2%,冗余度3.59)。二级螺旋结构用方框标记。(C) 来自\(Hb_{\beta}\)的整理后的HDX-MS数据覆盖图(13个肽段,覆盖率87.8%,冗余度1.82)。二级螺旋结构用方框标记。(D) 来自肽段2 \(Hb_{a}\)的时间分辨HDX-MS数据。(E) 来自\(Hb_{\beta}.\)的肽段33 – 42的时间分辨HDX-MS数据。
在模型化合物验证中,HDXchip 展现出优异的性能:血管紧张素 II(ATII)、缓激肽(BK)等模型肽的反向交换率低至 – 7.4%,胰岛素等蛋白质的全局 HDX 分析重复性良好(相对标准偏差 <5%)。这种低反向交换特性源于 “低温 + 集成化” 的双重优势 —— 缩短的分析流程减少了样品暴露时间,亚零温度则降低了氢氘交换动力学速率,较传统方法更适合捕捉蛋白质的瞬时构象变化。
在血红蛋白(Hb)的局部 HDX 分析中,芯片实现了 81.0%(α 亚基)和 87.8%(β 亚基)的序列覆盖率,通过离子淌度质谱辅助可进一步提升至 97.2%。时间分辨数据显示,血红蛋白的 αG 和 βG 螺旋区域因处于亚基界面而具有低氘摄取率,与晶体结构分析结果一致,证明了芯片在蛋白质构象动态研究中的可靠性。这种局部分析能力得益于 IMER 的高效酶解(肽段产率与传统柱酶解相当)与微流控分离的高灵敏度(检测限达 pmol 级别)。
系统耐用性测试表明,热处理后的硫醇 – 烯芯片可耐受超过 200 次连续运行而无物理损坏,固定化酶微反应器的活性保持时间约 3-5 天,而填充型胃蛋白酶琼脂糖微球的寿命可延长至数周,满足常规实验需求。这种稳定性优势使其有望替代传统 UPLC 系统,成为 HDX-MS 的常规分析平台。
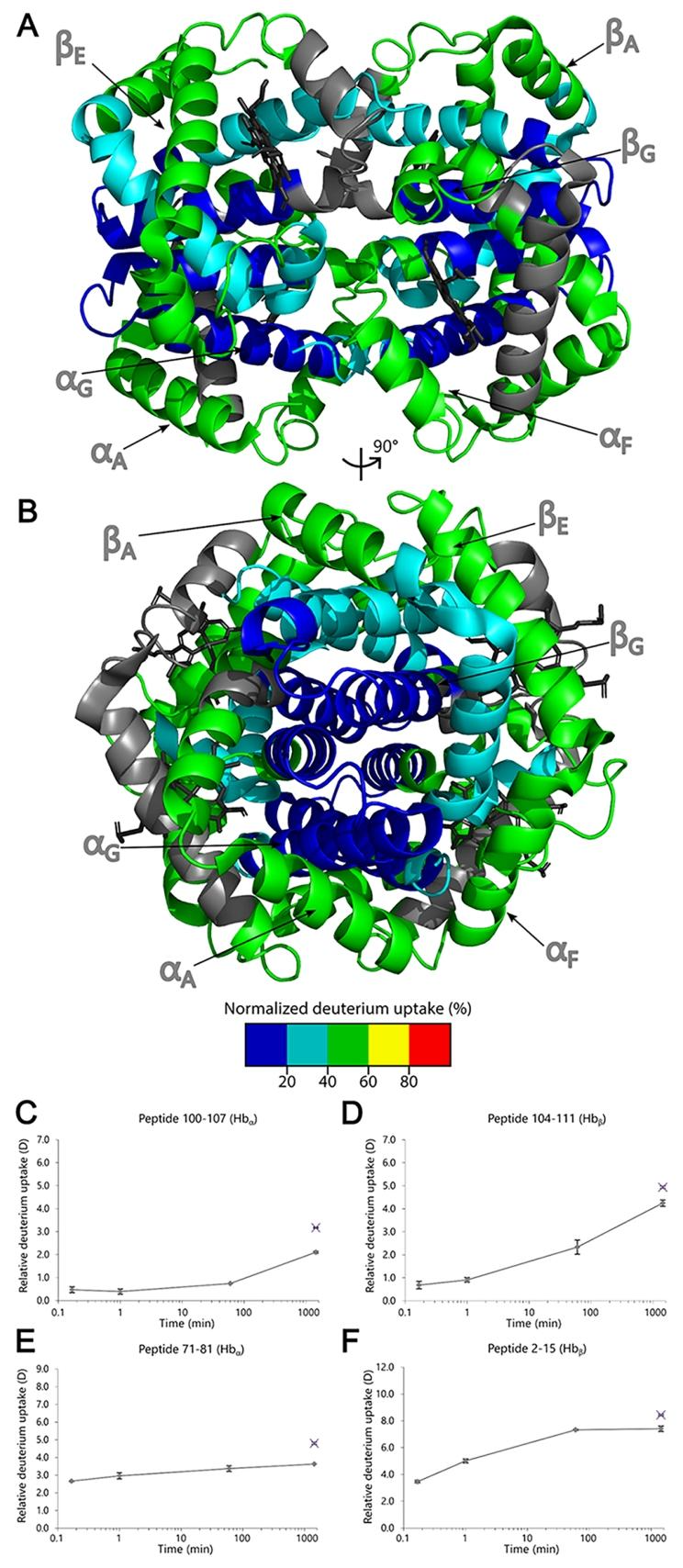
HDX数据映射到晶体结构。(A, B) 血红蛋白的晶体结构(PDB:4HHB),用标记10秒后的标准化HDX数据进行映射。晶体结构的颜色表示标准化摄取量。灰色表示时间分辨HDX数据中未覆盖的蛋白质区域。血红素基团显示为黑色。(C, D) 位于\(\alpha_{1} \beta_{1}-\alpha_{2} \beta_{2}\)界面中\(\alpha_{G}\)和\(\beta_{G}\)螺旋中的受保护肽的HDX图谱;最大标记样本用十字表示。(E, F) \(Hb_{a}\)在非结构化铰链区的71 – 81肽和\(Hb_{\beta}\)位于\(\beta_{A}\)螺旋中的2 – 15肽的HDX图谱,最大标记样本用十字表示。
5. 微流控技术在 HDX-MS 中的发展潜力
HDXchip 的成功验证为微流控技术在生物大分子分析中的应用开辟了新路径。与传统方法相比,其核心优势体现在三方面:一是成本优势,硫醇 – 烯材料与批量制造工艺可将单芯片成本降至传统玻璃芯片的 1/10;二是性能提升,集成化设计与低温控制使反向交换率降低 20-30 个百分点;三是灵活性,通过更换功能模块(如不同固定化酶或色谱填料),可扩展至糖蛋白分析、翻译后修饰鉴定等场景。
未来发展方向聚焦于三方面改进:其一,优化色谱分离效率,通过采用更小粒径填料(如 3μm C18)或整体柱技术提升峰容量,缩小与 UPLC 系统的差距;其二,开发集成化检测接口,将电喷雾 ionization(ESI)探针直接集成于芯片出口,减少死体积并提高离子传输效率;其三,拓展多模块联用,结合样品预处理(如脱盐、富集)与多维分离技术,应对更复杂的生物样品(如细胞裂解液、血清)。
从更广泛的微流控领域来看,HDXchip 的设计理念为 “功能集成 + 精准调控” 提供了范例。其材料选择、加工工艺与系统集成思路可推广至类器官芯片的动态取样分析、单细胞蛋白质组学等前沿领域,推动微流控技术从 “实验室工具” 向 “常规分析平台” 的跨越。
Dxfluidics Products
定制产品开发是顶旭产品系列发展的基础能力。顶旭微控接受各种材料微流控芯片定制(PDMS、玻璃、塑料及其他材质)
Contact Information



© 2025. All Rights Reserved. 苏ICP备2022036544号-1















