1. 引言
在肿瘤研究与药物开发领域,传统 2D 细胞培养难以复刻体内微环境,动物实验又存在伦理争议与成本高昂的问题。微流控器官芯片技术的出现,为解决这一困境提供了全新路径 —— 它通过精准模拟体内生理结构与动态环境,结合微纳加工与 MEMS 加工技术,实现了细胞培养与代谢监测的一体化。近年来,一款集成电化学传感器阵列的微流控器官芯片平台脱颖而出,其基于 PDMS 微流控芯片的核心结构,融合 SU8 模具制备、光刻胶模具加工等关键工艺,成功实现了 3D 细胞培养中氧气、乳酸、葡萄糖等代谢物的实时监测,为个性化医疗与肿瘤精准治疗奠定了技术基础。
该平台不仅整合了微纳加工、深硅刻蚀、阳极键合等先进制造技术,还兼容了表面修饰(如 PEG 修饰、醛基化修饰)等功能化处理,可适配类器官芯片、3D 细胞培养芯片等多种应用场景,其性能在三阴性乳腺癌干细胞的体外培养与药物测试中得到了充分验证,成为微流控芯片定制化应用的典型范例。
2. 平台设计与核心制备工艺
1) 芯片结构与材料体系
该微流控器官芯片以 500μm 厚的 Pyrex 硼硅玻璃为基底,通过 MEMS 加工工艺构建核心流体通道与细胞培养腔室。芯片的流体壁、屏障结构采用 SU8 光刻胶制备,形成 280μm 厚的多层结构,其中 SU8 模具的精准成型的关键,其加工过程融合了光刻、显影、硬烘等步骤,确保了通道尺寸的一致性与密封性。细胞培养腔室与流体通道之间的屏障结构设计独特,由 40μm 高的台阶与等边三角形凸起组成,可实现 PDMS 与 Matrigel 混合凝胶的无泄漏填充,这一设计充分发挥了 PDMS 芯片良好的生物相容性与成型能力。
在传感器集成方面,芯片底部通过磁控溅射沉积钛 / 铂电极层,经光刻图案化后形成氧气、乳酸、葡萄糖传感器阵列,电极表面的钝化层采用硅 nitride 与氧化硅堆叠结构,通过反应离子刻蚀(RIE)实现电极区域的精准开窗。传感器的功能化修饰则结合了表面修饰技术,如在生物传感器表面沉积 m – 聚苯二胺薄膜作为选择性渗透层,乳酸氧化酶与葡萄糖氧化酶通过 pHEMA 水凝胶固定,确保了检测的特异性与稳定性。
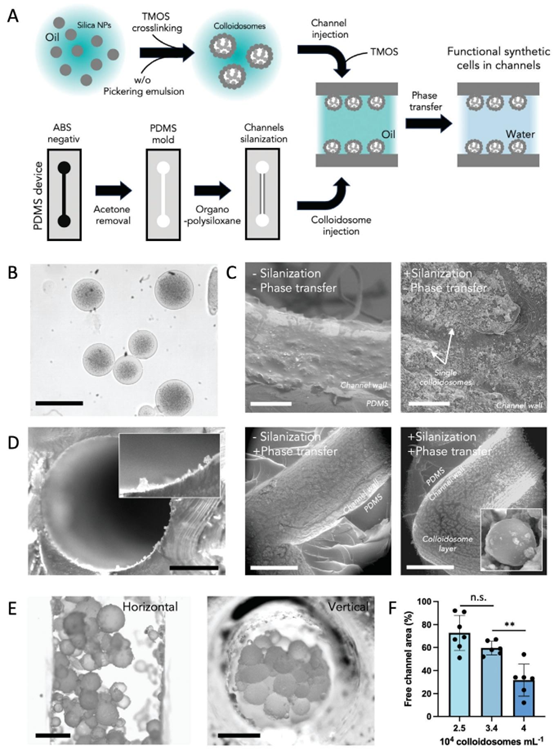
图1 系统设计、配置和微制造。(a)传感器玻璃芯片的俯视图,该芯片包含两个用于基于基质的球体培养的细胞腔室,以及三个相邻的微通道,用于培养基供应和培养条件的流体控制。集成了用于氧气、乳酸和葡萄糖的电化学微传感器,用于连续代谢监测。(b)组装好的装置照片,该装置填充有彩色水凝胶并带有附着的PMMA盖子。电传感器读数通过定制的印刷电路板完成。相差显微照片显示培养五天后球体腔室内的乳腺癌干细胞(BCSC1)球体。(c)示意性横截面图,包括所用材料和技术。(d)构成流体结构的图案化SU-8结构的扫描电镜显微照片。屏障结构可实现细胞外基质水凝胶的无泄漏填充。照片显示填充了凝胶的细胞腔室。
2) 关键制造流程
芯片的制备流程深度整合了微纳加工与 MEMS 加工技术:首先通过等离子增强化学气相沉积(PECVD)在玻璃基底沉积绝缘层,随后采用光刻胶 AZ 5214E 进行图形化,通过剥离工艺制备电极结构;SU8 模具的制备采用多层涂胶与紫外曝光技术,每层涂胶厚度控制在 40-80μm,经多次软烘、曝光、后烘与显影,形成复杂的流体通道与屏障结构;芯片封装采用 PMMA 盖板与玻璃基底的环氧粘接,确保气密封性,避免培养环境中气体组分的流失。
此外,芯片的功能拓展还兼容了深硅刻蚀、阳极键合等工艺,可根据需求集成微流控二维码识别、细胞分选芯片等模块,同时支持 PDMS 芯片定制化加工,如通过 PDMS 浇筑器制备个性化的细胞培养腔室,或结合光刻胶模具实现微流道的精准复刻。
3. 核心功能与实验验证结果
1) 质量传输与微环境调控
该平台通过三通道流体设计实现了微环境的精准调控,中间通道用于培养基灌注,两侧通道可静态或动态切换,形成对称或梯度化的物质分布。实验中以过氧化氢为模型分子,验证了物质在 PDMS 凝胶与流体通道间的扩散特性,结果与 COMSOL 模拟高度吻合,表明该设计可有效控制营养物质、药物分子的传输效率。对于多细胞共培养场景,平台可通过流体切换实现细胞间的 “通讯” 与 “隔离”,为研究细胞相互作用提供了灵活的工具。
在实际应用中,该功能可与器官芯片加工技术结合,针对不同组织类型(如肝、肺、肾)的代谢需求,通过微纳加工调整通道尺寸与扩散屏障,适配类器官芯片的个性化培养需求。
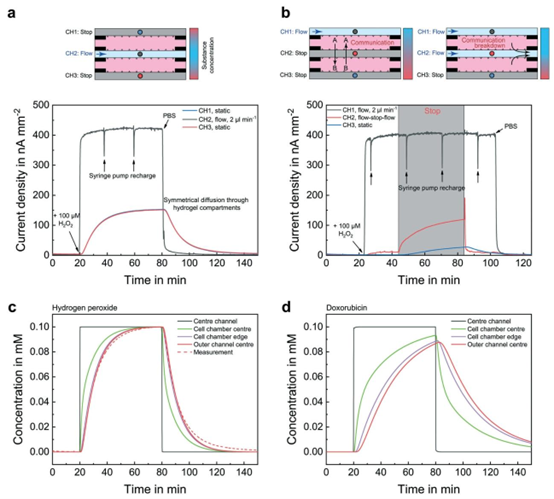
图2 质量传输控制研究。PBS中的\(H_{2} O_{2}\)被用作测试物质,并通过位于每个微通道中心的微型传感器进行测量。(a)液体灌注仅在中间通道内进行,导致两个球体隔室内的微环境相同,这体现在重叠的传感器信号上。(b)第二种操作模式,向外部通道施加恒定流量。如果中间通道内的灌注停止,两个隔室之间会形成浓度梯度,允许不同细胞类型进行通信。向同一通道施加流量会通过流体分离中断这种通信。(c)过氧化氢(\((D_{liq }=2.50 ×10^{-9} ~m^{2} ~s^{-1}\),\(D_{gel }=1.875 ×10^{-9} ~m^{2} ~s^{-1}\))从中心通道扩散到细胞室的质量传输计算模型。测量结果与模拟行为非常吻合,证实传感器信号遵循基本原理,且质量传输以扩散为主。(d)更大分子(抗癌药物阿霉素,\((D_{liq }=\)、\(0.58 ×10^{-9} ~m^{2} ~s^{-1}\)、\(D_{gel }=4.35 ×10^{-10} ~m^{2} ~s^{-1} )\))进入细胞室的质量传输计算模型。
2) 代谢物实时监测性能
平台集成的电化学传感器展现出卓越的检测性能:氧气传感器采用 chronoamperometric 协议,通过铂电极的氧化还原循环实现清洁与检测,检测限低于 1μM,在含血清的培养基中连续运行一周无漂移;乳酸与葡萄糖传感器的检测限分别为 6.1μM 与 7.6μM,线性范围覆盖生理浓度区间,且通过 pHEMA 水凝胶的扩散限制修饰,有效避免了蛋白质吸附导致的性能衰减。
传感器的集成位置经过优化:氧气传感器分别位于流体通道与细胞培养腔室,可同时监测培养基供氧与细胞周围微环境的氧气浓度;乳酸与葡萄糖传感器则置于通道下游,避免检测过程中产生的过氧化氢对细胞造成损伤。这种设计在 3D 细胞培养中尤为重要,可实时捕捉细胞增殖过程中代谢物浓度的动态变化,如三阴性乳腺癌干细胞形成类器官时,氧气消耗率随细胞密度增加而升高,倍增时间达 21.7 小时。
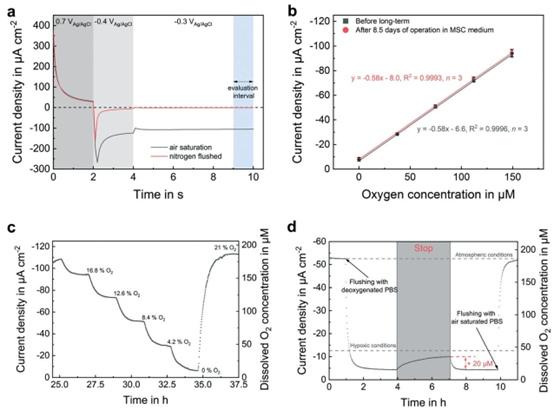
图3 氧气传感器和气密性表征。在\(10 \mu min^{-1}\)处,向中间通道施加中等流量。两个外侧通道保持静止。(a)在空气饱和的PBS和氮气冲洗的PBS中,计时电流法氧气测量方案的传感器响应。取最后一秒的平均电流密度用于数据评估。(b)在MSC培养基中进行长期测量前后的氧气传感器校准。误差线为标准差。(c)瞬态氧气校准。(d)通过流体装置降低氧气浓度并随后停止灌注来验证气密性。即使在3小时没有无氧电解液主动供应的情况下,类球体隔室内的溶解氧浓度仍处于缺氧状态。
3) 3D 细胞培养与药物筛选应用
实验中采用的三阴性乳腺癌干细胞(BCSC1)经胰酶消化后,悬浮于 Matrigel 与培养基的混合体系中,通过标准移液枪注入芯片的细胞培养腔室,SU8 屏障结构确保了细胞的均匀分布。在动态培养基灌注条件下,单个干细胞逐渐形成直径约 50μm 的类器官,其形态与尺寸分布与传统孔板培养一致,但代谢活性更接近体内肿瘤组织 —— 表现出显著的糖酵解特性,即使在常氧条件下仍产生大量乳酸,这一现象与肿瘤组织的瓦伯格效应高度吻合。
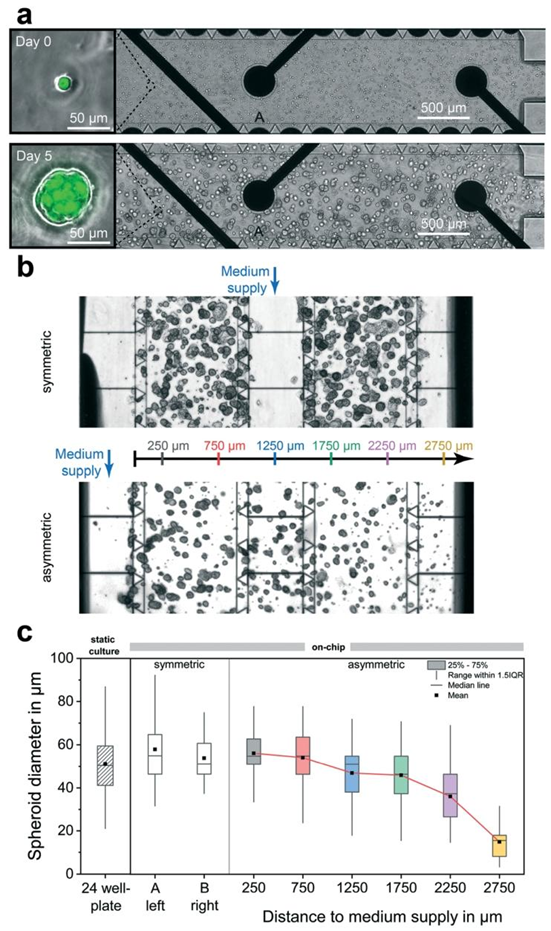
图4 芯片上肿瘤球体的形成。(a)接种密度为2 \(×10^{6} cells ml^{-1}\) 时,接种和凝胶化后,单个乳腺癌干细胞(BCSC1)包埋在75%基质胶中的相差显微镜图像。在数天的细胞培养基动态供应过程中,球体会在隔室内形成。比例尺,500 μm。插图显示单个细胞和球体的显微镜叠加图像(相差和绿色荧光)。比例尺,50 μm。(b)相差显微镜图像显示培养第5天的球体,这些球体在两种不同的培养基供应情况下生长。接种密度:\(1.5 ×10^{6} cells ml^{-1}\)(顶部)、\(0.5 ×10^{6} cells ml^{-1}\)(底部)。(c)传统孔板中静态条件下(接种密度:\(1.5 ×10^{6}\) \(cells ml\))和芯片上两种动态情况下(\((n ≥58)\))的球体直径分布比较。
药物筛选实验中,平台成功监测了抗霉素 A 与多柔比星对类器官代谢的影响:抗霉素 A 通过抑制线粒体电子传递链,使氧气消耗率在 1 小时内急剧下降;多柔比星则在高浓度(300ng/mL)下导致细胞凋亡,表现为氧气浓度升高与乳酸生成减少。这一结果表明,该平台可实时量化药物对细胞代谢的影响,为药物 efficacy 与毒性评估提供精准数据,相比传统终点检测方法更具时效性与准确性。
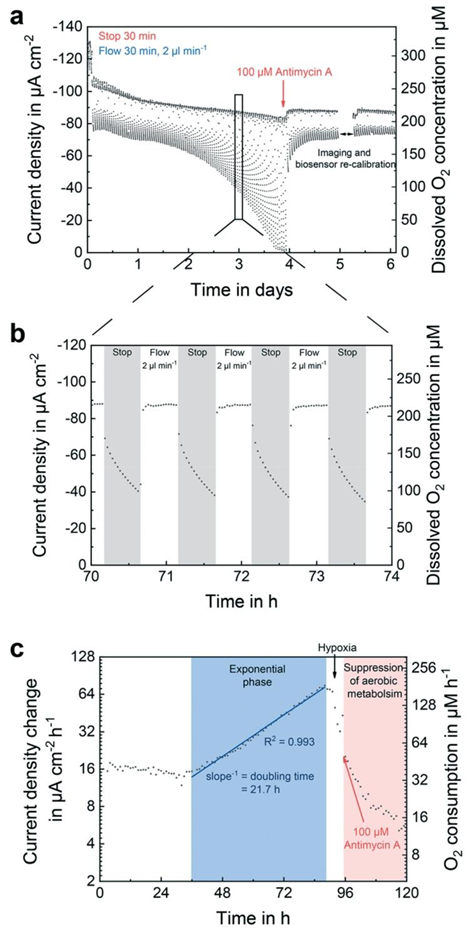
图5 在线氧气监测。在乳腺癌干细胞(BCSC1)球体形成期间,在\(2 ×10^{6} cells ml^{-1}\)的接种密度下,对中央灌注通道进行氧气监测。间充质干细胞(MSC)培养基以停流/流动循环方式灌注。每2分钟测量一次氧气浓度。(a)球体形成期间6天内的氧气测量,包括暴露于代谢改变药物抗霉素A的情况。(b)同一测量在第3天的4小时时间段。每个测量点代表特定时间的氧气浓度。(c)随时间变化的氧气消耗量,其中数据评估采用每个停流阶段最后5个浓度值的线性拟合斜率。
4. 行业应用与发展前景
1) 个性化医疗领域
该平台的核心优势在于可采用患者来源的干细胞构建类器官模型,结合微流控芯片定制化服务,为个性化治疗方案的制定提供依据。例如,针对三阴性乳腺癌患者,可通过芯片培养其肿瘤干细胞形成的类器官,快速筛选敏感化疗药物,避免无效治疗与副作用。此外,平台支持长期培养与实时监测,可追踪治疗过程中肿瘤细胞的耐药性变化,为治疗方案的调整提供动态数据。
2) 药物开发与基础研究
在药物开发领域,该平台可显著降低候选药物的筛选成本,缩短研发周期 —— 通过微流控芯片的高通量设计,可同时开展多种药物浓度、多种细胞类型的平行实验,结合 MEMS 加工的标准化生产,确保实验结果的可重复性。在基础研究中,平台可用于探索肿瘤微环境的关键因素,如缺氧、营养梯度对肿瘤进展的影响,或通过细胞共培养芯片研究肿瘤细胞与免疫细胞的相互作用。
3) 技术拓展与产业融合
该平台的技术架构具有高度的扩展性,可通过集成更多传感器(如 pH、一氧化氮传感器)拓展检测参数,或结合微流控二维码实现样本的精准溯源。在制造端,平台可与 PDMS 芯片加工、光刻胶模具制备、深硅刻蚀等成熟产业结合,降低规模化生产成本;同时,表面修饰技术(如 PEG 修饰、醛基化修饰)的融入,可进一步提升芯片的生物相容性与功能多样性,适配更多细胞类型的培养需求。
5. 结语
这款集成电化学传感器的微流控器官芯片平台,通过融合 PDMS 微流控芯片、MEMS 加工、微纳加工、SU8 模具制备等关键技术,实现了 3D 细胞培养代谢物的实时、精准监测,为肿瘤研究与个性化医疗提供了强大的工具。其在三阴性乳腺癌类器官培养与药物筛选中的成功应用,验证了技术的可行性与实用性,也为微流控芯片定制化、器官芯片加工的产业化发展奠定了基础。
未来,随着深硅刻蚀、阳极键合等制造技术的不断升级,以及表面修饰、传感器集成等功能的持续优化,该类平台将在药物开发、临床诊断、基础医学研究等领域发挥更大作用,推动微流控与器官芯片技术从实验室走向临床,为精准医疗的发展注入新的动力。
参考文献:DOI: 10.1039/d1lc00689d
顶旭微控产品
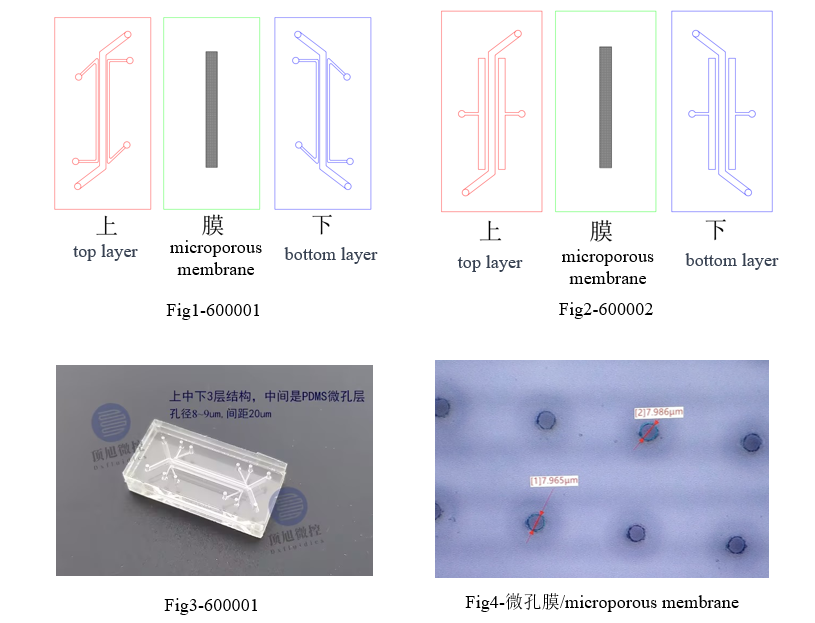
| 产品编号 | 外形 (mm) | 流道 | 微孔膜 | 材料 | 价格 (CNY) | |||
| 高 (mm) | 宽度 (mm) | 间距 (mm) | 厚度 (um) | 孔径 (um) | ||||
| 600001 | 30*15 | 0.5 | 1 | 0.2 | 25 | 8 | PDMS | 800 |
| 600002 | 30*15 | 0.5 | 1 | 0.5 | 25 | 8 | PDMS | 800 |
订购方式



© 2026. All Rights Reserved. 苏ICP备2022036544号-1













