一、引言:微流控与合成生物学的跨界融合
微流控技术作为 21 世纪生命科学领域的核心工具,凭借其精准操控微量液体、模拟体内微环境的优势,已成为器官芯片(organ-on-a-chip)、细胞培养芯片研发的核心支撑。其中,PDMS(聚二甲基硅氧烷)芯片因良好的生物相容性、易加工性,成为微流控器件的首选材料,其制备过程涉及 PDMS 键合机、对准平台、光刻胶模具等关键加工设备,依托 MEMS 加工、微纳加工平台实现高精度通道结构构建。
传统微流控芯片多聚焦于细胞培养与分析,而合成生物学的发展为其注入了新的活力。合成细胞作为模拟天然细胞生物物理与生化特性的人工模型,在分子层面的可定制性使其具备成为微流控功能组件的巨大潜力。然而,此前合成细胞多作为微流控的 “产物” 而非 “功能核心”,二者的深度功能整合尚未得到充分探索。近期发表于《Advanced Healthcare Materials》的研究,首次实现了胶体体基合成细胞与 3D PDMS 微流控器件的共价整合,构建出 “合成细胞驱动型” 器官芯片,为淋巴结芯片等特定功能器件的研发提供了全新范式,也为微流控芯片定制、器官芯片加工技术开辟了新方向。
二、核心技术:合成细胞与微流控芯片的整合方案
(一)PDMS 微流控器件的制备与合成细胞锚定
该研究基于 MEMS 加工工艺,通过 ABS 模具注塑、丙酮溶解成型等步骤制备 3D PDMS 微流控通道,结合硅烷化处理与四甲基 orthosilicate(TMOS)交联技术,实现硅基胶体体在通道壁的稳定锚定。胶体体作为合成细胞的核心载体,具备机械刚性(212.3 kPa ± 161.0 kPa),可耐受微流控通道内的高流速(约 100 kPa)与细胞牵引应力,其尺寸(17.3 μm 至 111.4 μm)可通过乳液液滴调节,密度(250,000–400,000 个 /mL)可灵活调控以模拟不同组织的细胞密度。
在加工过程中,PDMS 浇筑器、烘箱、打孔器等设备保障了器件的成型精度,而硅烷化处理与 TMOS 交联技术则解决了合成细胞与 PDMS 芯片的共价结合难题,避免了培养过程中结构脱落或生物降解,为长期稳定的细胞培养提供了基础。这种整合方案充分发挥了 PDMS 芯片加工平台的灵活性,实现了合成细胞网络与微流控通道的无缝衔接。
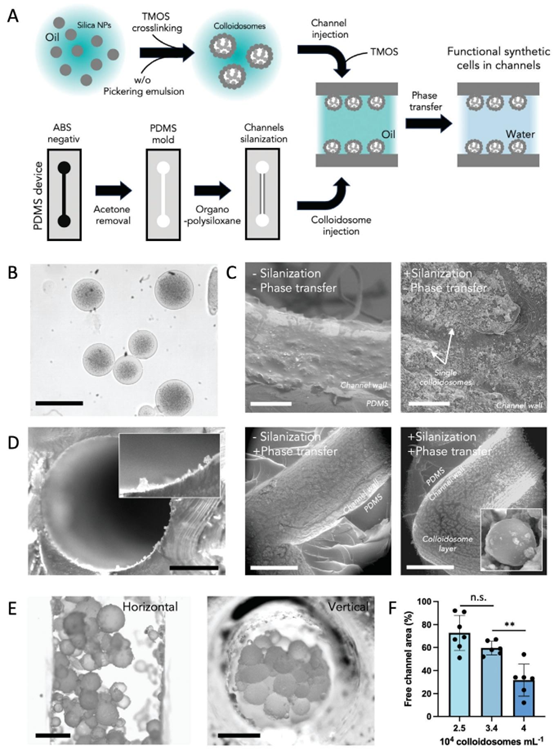
图1. 胶体体整合到微流控通道中。A)3D微流控装置和胶体体组装过程的示意图。B)二氧化硅胶体在水性缓冲液中悬浮的代表性明场显微镜图像。比例尺为50μm。C)功能化有胶体体(转移前后)以及有无通道盐化的PDMS通道水平横截面的SEM显微照片。比例尺为80μm(上图)和1mm(下图)。D)微流控通道的代表性体视显微镜图像
(二)支撑脂质双层修饰与细胞信号交互
为模拟天然细胞的表面交互功能,研究通过小单层囊泡(SUVs)融合,在胶体体表面构建支撑脂质双层(SLB)。该修饰策略不仅赋予合成细胞表面配体的横向流动性,还可通过 DGS-NTA (Ni²⁺) 介导重组蛋白(如 ICAM1、抗 CD3/CD28 抗体)的定向固定,配体密度可在 10–300 分子 /μm² 范围内精准调控。
SLB 的构建解决了传统微流控芯片表面修饰的功能局限,其荧光恢复_after 光漂白(FRAP)验证显示,脂质层具备良好的流动性,可促进免疫突触等细胞间信号簇的形成。这一技术与芯片表面修饰中的 PEG 修饰、氨基化修饰等策略互补,为微流控芯片的功能化提供了更接近天然细胞的解决方案。
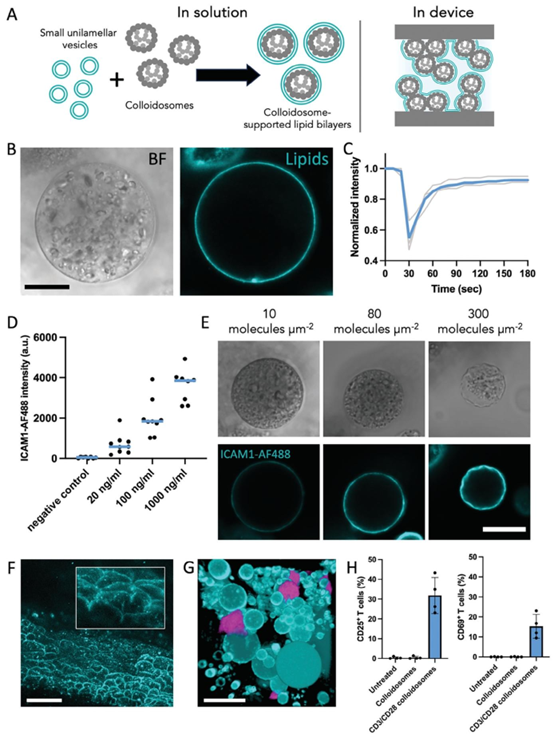
图2. 胶体体支撑脂质双层的形成。A)在溶液中(左)和微流控装置内(右),从小单层囊泡(SUVs)在胶体体上形成支撑脂质双层(SLB)的示意图。B)在二氧化硅胶体体周围形成的脂质层(LissRhod B标记的脂质)的代表性明场和共聚焦显微镜图像。比例尺为20 μm。C)胶体体上支撑脂质双层的光漂白后荧光恢复分析。五条曲线分别来自五个单独的胶体体,蓝色曲线表示其平均值。D)AlexaFluor488偶联的细胞间黏附分子1(ICAM1)的荧光强度
(三)海藻酸水凝胶介导的细胞因子控释系统
针对 T 细胞扩增过程中细胞因子(如 IL-2、IL-4)的时序释放需求,研究在胶体体内封装海藻酸水凝胶核心,通过 CaCl₂诱导凝胶化形成 “核心 – 壳层” 结构。该系统将 IL-2 的释放周期从 8 小时延长至 48 小时,实现了与体内淋巴结炎症阶段相匹配的持续信号供给。
水凝胶控释技术与微流控芯片的结合,突破了传统细胞培养中细胞因子一次性添加的局限,其半透性特征允许小分子扩散,同时限制生物大分子的快速渗漏。这种设计与 3D 细胞培养芯片的需求高度契合,为模拟肿瘤微环境、干细胞龛等复杂组织的生化梯度提供了新工具。
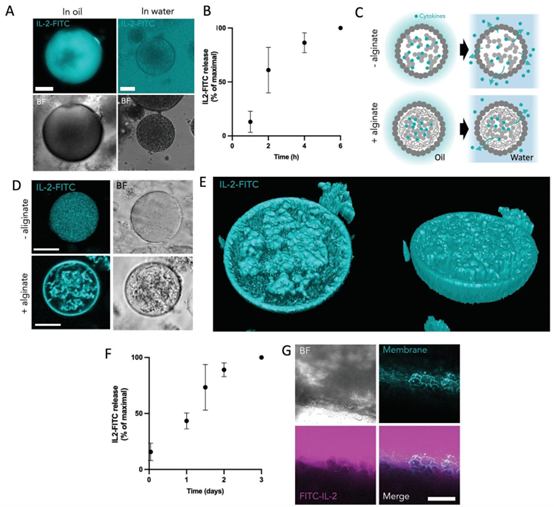
负载有海藻酸钙水凝胶和IL2-FITC。相变24小时后获取的图像显示,IL2-FITC释放到通道中。图3. 胶体在芯片上的细胞因子释放。A)IL2-FITC负载的胶体在油相中和转移到水环境后的代表性明场图像和z-stack最大共聚焦显微镜投影。比例尺为10μm。B)通过溶液中FITC荧光强度测量的从SLB包被的胶体释放到水环境中的IL-2-FITC的定量分析。结果以平均值±标准差表示,来自三个技术重复。C)存在或不存在海藻酸钙水凝胶核心时负载细胞因子的胶体的示意图。细胞因子结合到内部二氧化硅基质上。D)有和没有内部海藻酸钙水凝胶的IL-2-FITC负载胶体的代表性明场和共聚焦显微镜图像。比例尺为20μm。E)IL-2-FITC和海藻酸盐水凝胶负载胶体的共聚焦显微镜体积重建。F)通过溶液中FITC荧光强度测量的从具有内部海藻酸钙水凝胶核心的胶体释放到水环境中的IL-2-FITC的定量分析。结果以平均值±标准差表示,来自三个技术重复。G)沉积在PDMS微流控通道壁上的胶体层的明场图像和共聚焦显微镜图像的最大z投影,为了可视化,使用了平均尺寸为7.3μm的单层胶体。比例尺为200μm。
三、关键应用:淋巴结芯片驱动的 T 细胞高效扩增
(一)模块化淋巴结芯片的设计与构建
研究基于上述技术构建了 “即插即用” 型淋巴结芯片,通过串联两个功能模块模拟淋巴结炎症的不同阶段:第一模块(炎症初期)采用高密度胶体体网络(自由通道面积 35%),表面负载高浓度抗 CD3/CD28 抗体(300 分子 /μm²),实现 T 细胞的初始活化;第二模块(增殖阶段)降低配体密度(80 分子 /μm²),同时通过水凝胶释放 IL-2/IL-4,促进 T 细胞增殖与记忆表型分化。
该芯片采用螺旋通道设计延长细胞滞留时间,结合 20 μL/h 的连续流培养模式,实现了原代人 CD8⁺ T 细胞的高效扩增。其结构设计融合了微流控芯片的流体力学优化与器官芯片的功能模块化理念,为免疫微流控芯片的研发提供了可复用的设计框架。
(二)T 细胞扩增效果的优化与机制突破
实验结果显示,与传统 DynaBeads 扩增方法相比,淋巴结芯片培养的 T 细胞表现出更优的功能表型:IL-4/IL-5 分泌水平显著提升(Tc2 表型富集),PD-1/CTLA4 免疫检查点分子表达降低,表明细胞耗竭程度减轻。不同芯片设计对比证实,配体与细胞因子的时序呈现(而非同时呈现)是调控 T 细胞分化的关键,而胶体体密度介导的空间限制也显著影响细胞因子分泌谱。
这一发现为过继性 T 细胞治疗提供了新的技术路径,其核心优势在于通过微流控芯片的精准调控,模拟体内淋巴结的动态微环境,解决了传统体外扩增中 T 细胞功能耗竭的行业痛点。该技术与免疫疗法的结合,凸显了微流控芯片在细胞治疗产业化中的应用潜力。
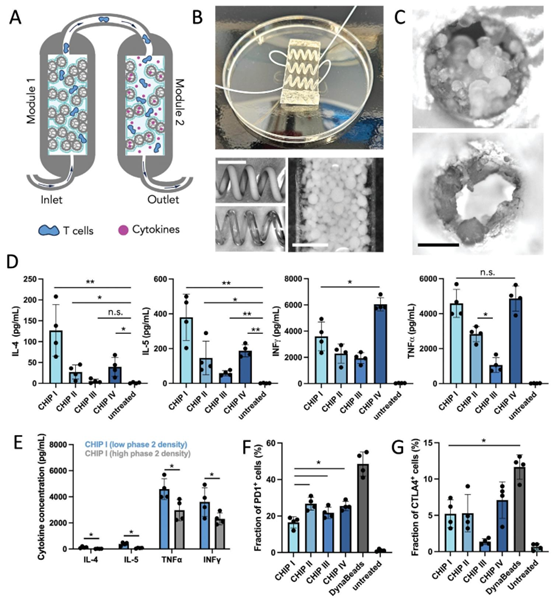
图4. 基于合成细胞的芯片上淋巴结。A)两个微流控模块的示意图,集成了不同组成和密度的合成细胞。图中显示了T细胞(蓝色)、细胞因子(红色)以及入口和出口通道。B)带有螺旋通道和集成胶体体的三模块微流控芯片照片。底部面板显示了螺旋ABS阴性的体视显微镜图像、ABS去除后的普通通道以及螺旋通道中胶体体网状结构的特写。比例尺分别为3毫米和500微米。C)模块1(顶部)和模块2(底部)的通道横截面体视显微镜图像,具有不同的胶体体网状结构密度。D)基于ELISA的IL-4、IL-5、TNF-α、INF-γ分泌定量分析,样本来自在四种不同芯片设计上培养的原代人CD8+ T细胞以及未处理的对照组。细胞因子水平在芯片上培养48小时后,再在培养基中培养48小时后进行测量。结果以平均值±标准差表示,\(n=4\)来自两个供体和两个技术重复。E)基于ELISA的IL-4、IL-5、TNF-α、INF \(- \gamma\)分泌定量分析,样本来自在芯片I设计上培养的原代人CD8+ T细胞,该芯片设计的第二个模块中具有高密度或低密度的胶体体网状结构。细胞因子水平在芯片上培养48小时后,再在培养基中培养48小时后进行测量。结果以平均值±标准差表示,4来自两个供体和两个技术重复。F和G 不同芯片设计扩增后PD-1+和CTLA4+ T细胞群的流式细胞术定量分析。结果以平均值±标准差表示,\(n=4\)来自两个供体和两个技术重复。双向方差分析,* \(^{*} p<0.05\),\(* * p<0.005\),ns=不显著。
四、行业价值与未来展望
(一)技术突破的行业意义
该研究首次将合成细胞从 “分析对象” 转变为微流控芯片的 “功能核心”,其创新点在于:通过 PDMS 芯片加工与合成生物学的跨界融合,实现了生物物理信号(配体密度、空间限制)与生化信号(细胞因子时序释放)的协同调控。这一突破不仅推动了器官芯片技术的升级,也为微流控芯片定制、MEMS 加工等产业链环节提供了新的应用场景。
在产业化层面,该技术可直接应用于免疫细胞治疗的细胞制备环节,通过微流控芯片的标准化生产,提升 T 细胞扩增的 reproducibility 与规模化水平。同时,其模块化设计兼容不同细胞类型(如 CAR-T 细胞、干细胞)的培养需求,为多器官芯片、类器官芯片的集成奠定了基础。
(二)未来发展方向
未来研究将聚焦三个核心方向:一是优化合成细胞的功能多样性,整合体外转录翻译系统(TX/TL)与光遗传学工具,实现细胞因子释放的动态调控;二是拓展芯片的临床适用性,针对肿瘤类器官芯片、血脑屏障芯片等特定场景,优化 PDMS 芯片的结构设计与表面修饰策略;三是推动技术的产业化转化,开发低成本的微流控芯片量产工艺,结合微流控检测仪实现扩增过程的实时监测。
从技术迭代来看,该研究采用的胶体体整合、SLB 修饰、水凝胶控释等技术,可与 3D 打印微流控芯片、数字微流控等新兴技术结合,进一步提升器件的功能复杂度与操作便捷性。同时,其与 MEMS 代工、微纳加工实验室的协同,将加速器官芯片从实验室走向临床应用的进程。
五、结语
合成细胞与 3D 微流控芯片的功能整合,为器官芯片技术开辟了 “人工细胞驱动” 的新方向。该研究通过 PDMS 芯片加工、MEMS 加工、表面修饰等核心技术的协同创新,构建了可模拟淋巴结动态微环境的功能器件,在 T 细胞扩增等免疫治疗领域展现出显著优势。随着技术的不断优化,合成细胞基微流控芯片有望成为细胞治疗、药物筛选、基础医学研究的核心工具,推动微流控行业从 “技术平台” 向 “功能系统” 的跨越,为精准医疗的发展提供强大支撑。
参考文献:https://doi.org/10.1002/adhm.202303334
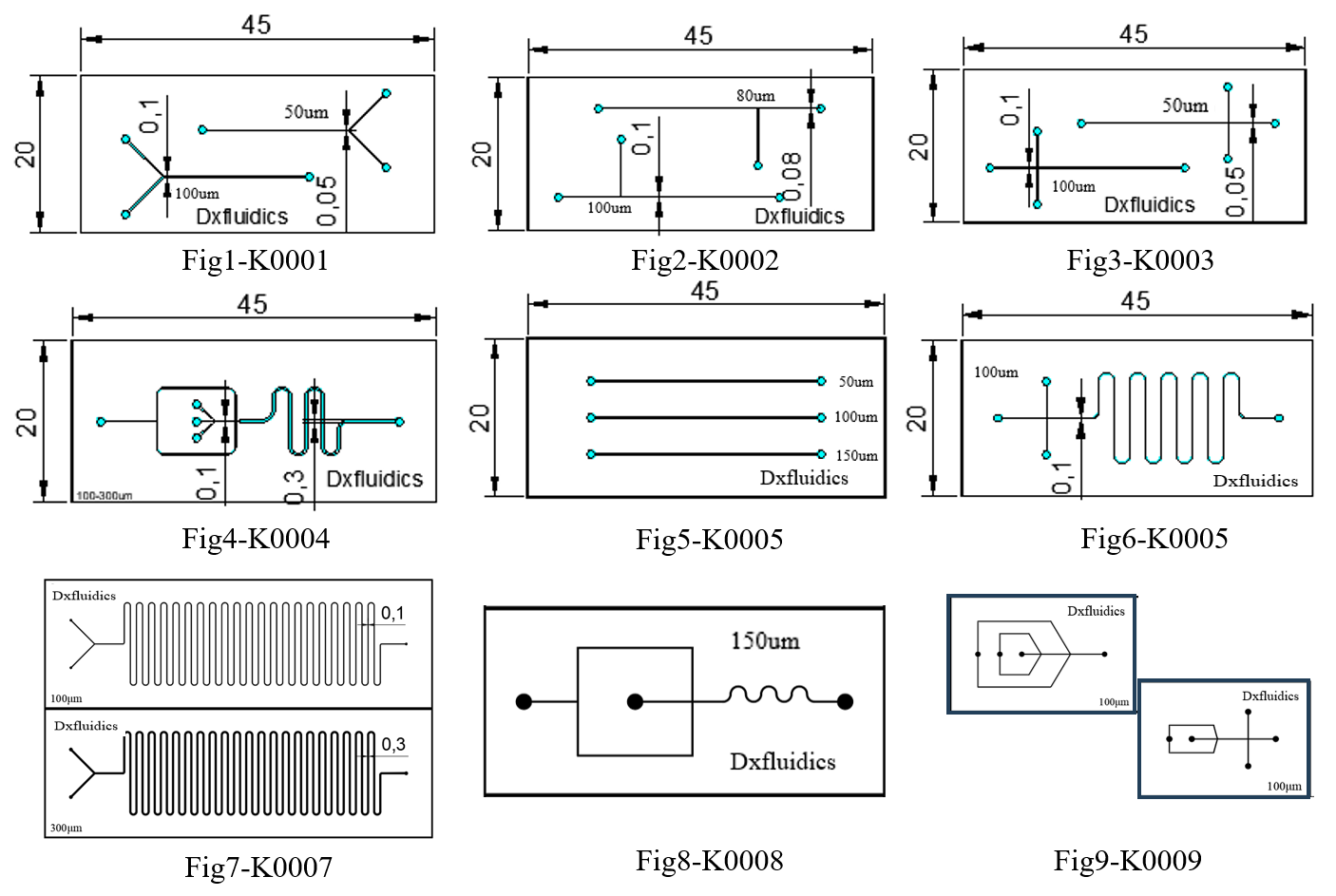
顶旭微控产品(标准PDMS芯片)
本公司也可提供特性化的微流控PDMS芯片加工服务,具体详情,欢迎来电咨询+86-17751163890(同微信),邮箱:sale@dxfluidics.com
| 产品编号 | 外形 (mm) | 高度 (um) | 宽度 (um) | 厚度 (mm) | 芯片材质 | 价格 (CNY) |
| K0001 | 45*20 | 50 | 50&100 | 3+1 | PDMS+Glass | 300 |
| K0002 | 45*20 | 50 | 80&100 | 3+1 | PDMS+Glass | 300 |
| K0003 | 45*20 | 50 | 50&100 | 3+1 | PDMS+Glass | 300 |
| K0004 | 45*20 | 50 | 100&300 | 3+1 | PDMS+Glass | 300 |
| K0005 | 45*20 | 50 | 50&100&150 | 3+1 | PDMS+Glass | 300 |
| K0006 | 45*20 | 50 | 100 | 3+1 | PDMS+Glass | 300 |
| K0007 | 75*25 | 100 | 100&300 | 3+1 | PDMS+Glass | 300 |
| K0008 | 52*25 | 100 | 100&150&200 | 3+1 | PDMS+Glass | 300 |
| K0009 | 35*24 | 100 | 100&200 | 3+1 | PDMS+Glass | 300 |
订购方式



© 2025. All Rights Reserved. 苏ICP备2022036544号-1












