在细胞生物学与微纳制造交叉领域,线粒体杂合细胞(transmitochondrial cybrids)的制备技术正经历从传统方法到微流控芯片技术的革新。传统方案依赖无丙酮酸 / 尿苷(PU)培养基进行选择性培养,而基于微流控装置的新方法突破了这一限制,实现了 PU 补充条件下的高效制备。本文将系统解析这一技术的核心流程、关键设备与材料,及其在器官芯片、细胞治疗等领域的应用前景。

在传统方法中,使用不含丙酮酸/尿苷(PU)的培养基进行选择性培养对于生成转线粒体胞质杂种至关重要。在此,我们介绍一种利用微流控装置生成转线粒体胞质杂种的方案,该方案即使在添加PU的条件下也能发挥作用。我们描述了微流控装置的制备、部分细胞融合(线粒体转移)以及转线粒体胞质杂种的收集步骤。随后,我们详细说明了通过限制性片段长度多态性(RFLP)分析确认胞质杂种中线粒体DNA(mtDNA)重新聚集和进行mtDNA分型的流程。
1. 线粒体杂合细胞制备的技术突破:从传统方法到微流控革新
线粒体杂合细胞作为研究线粒体功能与疾病关联的重要模型,其传统制备需通过去核供体细胞与 mtDNA 缺陷受体细胞融合,依赖无 PU 培养基筛选 —— 因 mtDNA 缺陷细胞(ρ⁰细胞)无法自主合成丙酮酸和尿苷,仅融合细胞可存活。但该方法存在筛选周期长、细胞活性低等问题。
微流控技术的介入实现了三大突破:一是 PU 补充条件下的选择性培养,通过微通道精准控制细胞微环境,无需依赖营养缺陷筛选;二是单细部分融合,利用微流控芯片的细胞配对结构(CPS)与微隧道设计,实现线粒体定向转移而避免细胞核融合;三是高效筛选与鉴定,结合 PCR 与限制性片段长度多态性(RFLP)分析,快速确认 mtDNA 来源。
这一技术依赖PDMS 芯片加工的高精度微结构 —— 通过软光刻技术制备的微隧道(长度 4-10μm)与细胞口袋,为供体(含 mtDNA 的 Purᵣ细胞)与受体(ρ⁰细胞)提供可控接触空间,配合 HVJ-E 病毒介导的融合体系,实现高效线粒体转移。
2. 核心实验流程:从细胞准备到杂合细胞收获
1) 供体与受体细胞的精准制备
实验需两类细胞:一是稳定表达嘌呤霉素抗性基因(Purᵣ)的供体细胞(如 HeLa 细胞),二是 mtDNA 完全缺失的 ρ⁰受体细胞(如 143B 细胞)。ρ⁰细胞制备需经溴化乙锭(EtBr)处理 30-60 天,每日更换培养基以清除 mtDNA,后续在 PU 培养基中培养 1 个月以上,通过 PCR 确认无 mtDNA 残留。
关键操作包括:
- 供体细胞需转入荧光标记基因(如 H2B-EGFP),受体细胞转入 mCherry 标记,便于后续追踪;
- 确保供体为 TK⁺、受体为 TK⁻,通过 BrdU 筛选清除未融合的供体细胞。
2) 微流控芯片的制备工艺
芯片制备以PDMS 材料为核心,通过软光刻技术实现微结构复刻,具体流程包括:

主模具制造流程示意图
- 光刻胶模具制作:在硅片上涂覆 SU-8 光刻胶,经紫外曝光、显影形成微隧道(第一层,2μm 厚)与细胞配对结构(第二层,26-28μm 厚),需精确对准两层图案(误差 < 0.5μm);
- PDMS 浇筑与固化:按 10:1 比例混合 PDMS 预聚体与交联剂,倒入模具真空脱泡后,65℃烘烤 1 小时固化,切割后打孔形成进出液口;
- 芯片组装:将 PDMS 芯片与玻璃载片可逆结合,避免等离子键合导致的细胞粘附干扰,确保微通道密封性。

光掩模设计总结
(A)细胞配对结构(CPS)的变化。微隧道长度由箭头所示的细胞凹穴之间的距离定义。比例尺:30微米。(B)硅片、第一层(微隧道)和第二层(CPS)之间的对准概述。透过对准标记窗口可以看到硅片上的对准标记。箭头图案有助于确定对准的Y轴位置。(C)CPS/微隧道设计的放大图。显示了带有短(4微米长)微隧道的CPS。关于光掩模设计的详细信息,请参见图1、图2、图3以及所提供的CAD数据(dwg文件:掩模#4、#20和#27)。比例尺:30微米。

微流控装置制备流程示意图
(A)空的主模具。(B-D)PDMS芯片制备步骤(步骤2-7)。(E)收集的PDMS芯片。(F-I)微流控装置制备步骤(步骤10-14)。

(A)切割固化的PDMS(步骤6)。(B)剥离PDMS(步骤7)。(C)清空母模。建议将母模空置存放,以避免PDMS粘在硅片上。(D)将PDMS芯片放置在干净的载玻片上(步骤8)。(E–G)修剪并打孔以制作出口和入口(步骤10)。(H)连接硅胶管以制作入口储液器(步骤11–13)。(I)将PDMS芯片放置在35毫米培养皿中(步骤14)。(J)由于无需连接任何外部设备,微流控装置可配备盖子。G-I中所示的PDMS芯片并不完全相同。
3) 部分细胞融合与杂合细胞筛选
融合过程通过微流控芯片的流体控制实现:
- 细胞悬液(0.5-1×10⁵ cells/100μL)注入芯片,440×g 离心 1 分钟使细胞进入 CPS,形成 1:1 配对;
- 注入含 HVJ-E 与 Y-27632(ROCK 抑制剂)的融合培养基,37℃培养 1 小时促进胞质桥形成,实现线粒体转移;
- 筛选分两步:先用 Pur 培养基清除未融合受体细胞,再用 PU/BrdU 培养基淘汰供体细胞,最终获得纯合杂合细胞克隆。

通过微隧道进行细胞融合的流程示意图 在该示意图中,线粒体未被显示。
3. 关键技术与设备:从微纳加工到检测系统
1) 微流控芯片加工设备
- 光刻系统:紫外光刻机(如 Union Optical PEM-800)用于 SU-8 图案曝光,需配合镀铬玻璃掩膜(精度达 μm 级);
- 等离子刻蚀机:用于硅片表面处理与微结构修饰,通过 O₂与 CHF₃等离子体实现亲疏水调控;
- PDMS 加工设备:包括匀胶机(控制光刻胶厚度)、烘箱(65℃固化)、打孔器(2mm 直径 biopsy trepan)等。
2) 细胞操作与检测工具

部分细胞融合的实现及后续分离
在本实验中,使用了具有105个CPS且带有短(4μm长)微通道的微流控装置。(A)实验概述。在CPS中捕获表达H2B-EGFP的HeLa细胞(供体细胞)和表达mCherry的\(143B\)细胞(受体细胞)后,通入融合培养基1小时,然后通入Pur选择培养基1天。本示意图中省略了线粒体。(B)融合细胞对的荧光图像。在本实验中,线粒体DNA未被可视化。细胞质中的mCherry从\(\rho^{0} 143 B\)细胞转移到HeLa细胞,表明它们之间发生了部分细胞融合。H2B-EGFP信号和mCherry信号分别以绿色和红色显示。相差:相差显微镜图像。融合前:细胞捕获后立即拍摄。融合后:通入融合培养基1小时后立即拍摄。所有图像放大倍数相同。比例尺:25μm。(C)B中所示融合细胞对的延时观察结果。实线箭头和虚线箭头分别表示HeLa细胞和ρ0143B细胞。星号表示从CPS外部移入的细胞。在通入Pur选择培养基的过程中,融合细胞自发分离,恢复为单个细胞。所有图像放大倍数相同。比例尺:50μm。部分数据已在Wada等人的研究中发表,1 此处根据出版商的版权政策进行重现。本文已获得CC BY许可。

使用了具有105个CPS、带有短(4μm长)微隧道或无微隧道(无隧道)的装置。(受体)细胞。实验使用表达H2B-EGFP的HeLa细胞(供体)和表达H2B-mCherry的\(\rho^{0} 143 B\)细胞进行。(B)第19天用方法2筛选的典型结果(另见图7)。在这些实验中,微流控(A)第8天用方法1筛选的典型结果(另见图7)。本实验使用具有1260个CPS、带有长(10μm长)隧道的微流控装置。左图:细胞的相差显微镜图像。箭头指示出现的集落。此时,供体细胞仍然存活。随后通过传代筛选,供体细胞被完全清除(数据未显示)。比例尺:500μm。右图:集落的放大相差显微镜图像和荧光图像。图11. 选择性培养期间出现的集落图像以相同放大倍数显示。比例尺:500μm。左图:使用短隧道装置的实验中细胞的相差显微镜图像。右图:使用无隧道装置的实验中细胞的相差显微镜图像。短隧道装置中出现明显的集落,而无隧道装置中未出现。绿色:供体细胞的细胞核(H2B-EGFP),红色:受体细胞的细胞核(H2B-mCherry)。图像以相同放大倍数显示。比例尺:100μm。

通过荧光显微镜观察确认线粒体DNA的存在 表达H2B-EGFP的HeLa细胞(供体)、表达H2B-mCherry的\(p143B\)细胞(受体)及所得胞质杂种的荧光图像。所有细胞均用PicoGreen染色。本实验中,使用短(4μm长)通道装置通过方法2生成胞质杂种(另见图7)。胞质杂种中存在细胞质PicoGreen信号表明线粒体DNA重新聚集。PG:PicoGreen。图像以相同放大倍数显示。标尺:50μm。
- 荧光显微镜:如 Olympus IX81,用于观察 EGFP/mCherry 标记的细胞融合状态;
- PCR 与电泳系统:通过 KOD 酶扩增 mtDNA 片段,结合 SspI 酶切与琼脂糖凝胶电泳,区分 HeLa(1854bp)与 143B(1289bp)来源的 mtDNA;
- 细胞培养设备:CO₂培养箱需维持 5% CO₂与 37℃环境,配合 PU 培养基(含 1mM 丙酮酸、1μg/mL 尿苷)实现杂合细胞扩增。
4. 应用前景与技术扩展
- 1). 疾病模型与药物研发
该技术可构建含特定 mtDNA 突变的杂合细胞,模拟线粒体疾病(如 Leber 遗传性视神经病),用于药物筛选。结合类器官芯片,可进一步构建 “杂合细胞 – 类器官” 模型,研究线粒体功能对组织发育的影响。
- 2). 微流控技术的横向扩展
- 器官芯片集成:将线粒体转移模块与多器官芯片结合,研究跨器官线粒体代谢协同;
- 自动化筛选:结合数字微流控芯片,实现细胞配对、融合、筛选的全流程自动化;
- 3D 细胞培养:在芯片中引入水凝胶支架,模拟体内微环境下的线粒体转移效率。
- 3). 技术优化方向
当前挑战包括:非贴壁细胞难以适配(依赖微隧道穿透的胞质桥)、HVJ-E 试剂停产(需替代病毒载体)。未来可通过微流控芯片表面修饰(如 PEG 涂层)改善细胞兼容性,或采用电融合技术替代病毒介导的融合。
参考文献:https://doi.org/10.1016/j. xpro.2025.103953
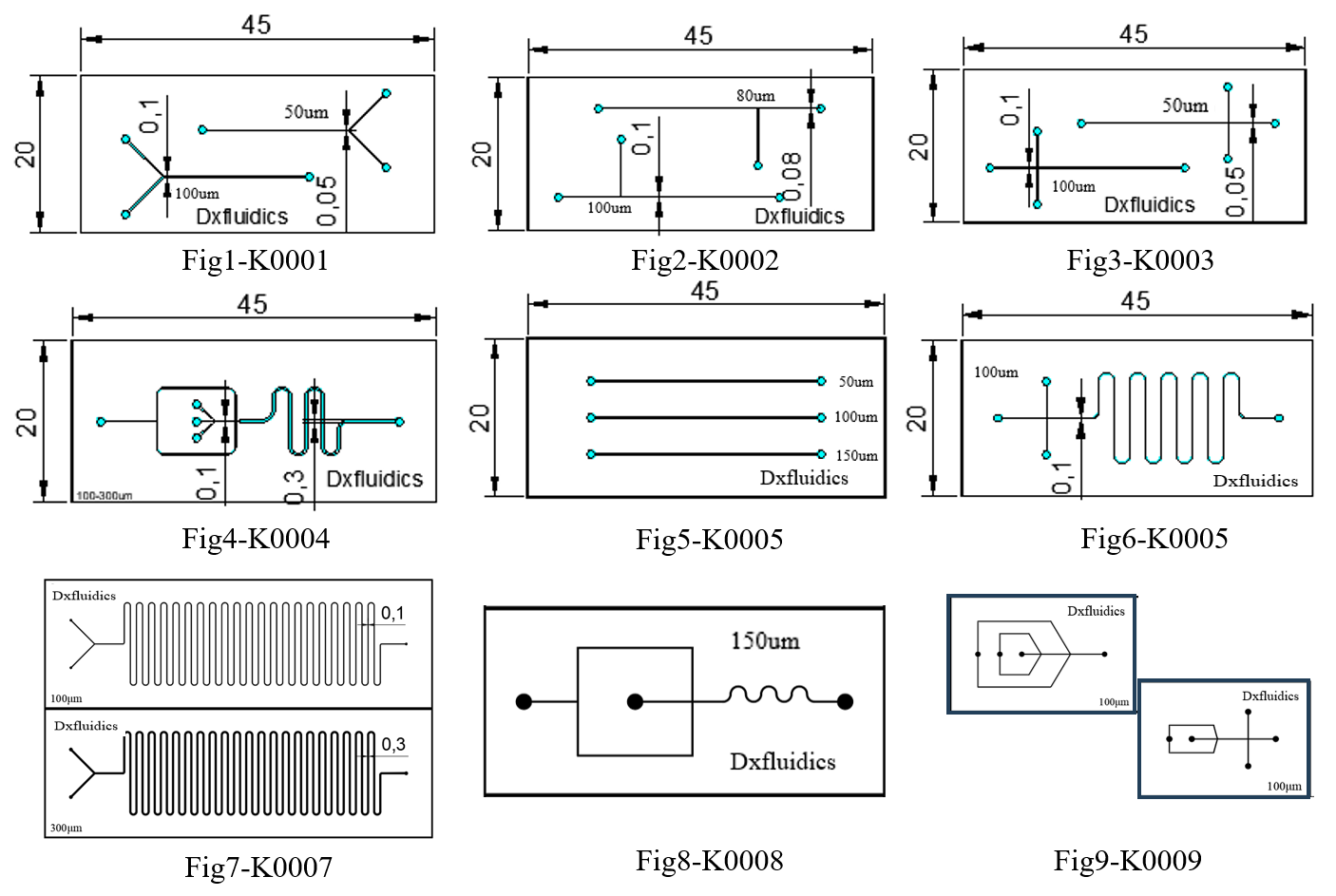
顶旭微控产品(标准PDMS芯片)
本公司也可提供特性化的微流控PDMS芯片加工服务,具体详情,欢迎来电咨询+86-18112558497(同微信),邮箱:sale@dxfluidics.com
| 产品编号 | 外形 (mm) | 高度 (um) | 宽度 (um) | 厚度 (mm) | 芯片材质 | 价格 (CNY) |
| K0001 | 45*20 | 50 | 50&100 | 3+1 | PDMS+Glass | 300 |
| K0002 | 45*20 | 50 | 80&100 | 3+1 | PDMS+Glass | 300 |
| K0003 | 45*20 | 50 | 50&100 | 3+1 | PDMS+Glass | 300 |
| K0004 | 45*20 | 50 | 100&300 | 3+1 | PDMS+Glass | 300 |
| K0005 | 45*20 | 50 | 50&100&150 | 3+1 | PDMS+Glass | 300 |
| K0006 | 45*20 | 50 | 100 | 3+1 | PDMS+Glass | 300 |
| K0007 | 75*25 | 100 | 100&300 | 3+1 | PDMS+Glass | 300 |
| K0008 | 52*25 | 100 | 100&150&200 | 3+1 | PDMS+Glass | 300 |
| K0009 | 35*24 | 100 | 100&200 | 3+1 | PDMS+Glass | 300 |
订购方式



© 2026. All Rights Reserved. 苏ICP备2022036544号-1













