参考文献:https://doi.org/10.1038/s41378-025-00938-y
1. 微流体芯片的设计与制备工艺
SDFAST(Self Dilution for Faster Antimicrobial Susceptibility Testing)作为一种新型微流体芯片系统,其核心设计采用了双层 SlipChip 结构,由顶层芯片与底层芯片组成,通过精准对齐实现流体控制。该芯片选用 3mm 厚的聚甲基丙烯酸甲酯(PMMA)作为基材,利用微铣削技术替代传统化学蚀刻工艺,不仅将单套芯片的制备时间缩短至 30 分钟以内,还能通过计算机系统灵活调整加工参数,极大提升了工艺的灵活性。这种加工方式与 MEMS 加工技术中的微纳制造理念相契合,通过 2.5D 盲铣功能定义各组件高度,配合 0.9mm 螺旋钻具与 0.5mm 立铣刀完成 inlet、outlet 及微井结构的加工,最终经去离子水与乙醇清洗实现表面净化。
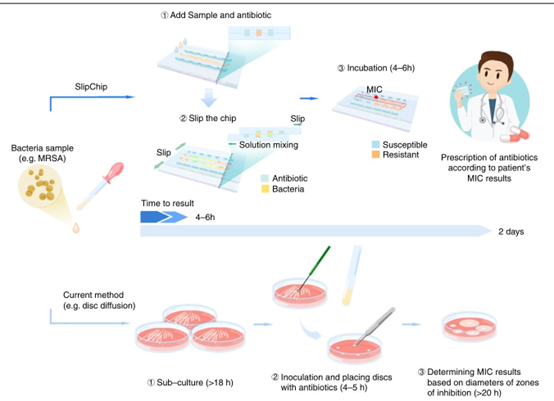
SDFAST与当前方法(如纸片扩散法)的对比示意图。当前方法的主要缺点之一是检测持续时间长,尤其是培养需要20多个小时。然而,在SDFAST中,培养时间缩短至4 – 6小时,这使得医生能够在一天内快速获得抗生素敏感性试验(AST)结果,并为患者开出相应的抗生素。在该示意图中,展示了SDFAST的一部分,以说明如何进行一种细菌 – 抗生素组合的测试。
在结构设计上,顶层芯片包含体积依次减半的微井阵列,底层芯片则采用恒定体积的纳米壁结构,通过滑动错位实现抗生素的梯度稀释。这种设计巧妙整合了微流控芯片模具的精密制造要求,其 840nL 至 6.563nL 的体积梯度设置,为后续的浓度梯度生成奠定了物理基础。芯片表面经氟烷基硅烷处理形成疏水层,并添加 1% 表面活性剂的 FC-40 溶液实现密封,有效解决了微流体系统中常见的蒸发与泄漏问题,这一工艺与 PDMS 芯片加工中常用的表面修饰技术异曲同工。
2. 微流体芯片的工作原理与核心技术
SDFAST 系统的工作流程分为加载、液滴形成与混合三个关键阶段,完美展现了微流控技术的精准操控特性。在加载阶段,上下芯片对齐形成流体通道,通过微量移液器将细菌悬液与抗生素溶液注入,多余液体经出口排出以平衡压力。这一过程类似于 PDMS 芯片加工中常见的流体灌注操作,但其创新点在于通过单次滑动实现双重功能:推动顶层芯片首先形成独立液滴并断开进出口连接,利用顶层微井的体积梯度完成抗生素的快速自稀释,随后进一步滑动使上下液滴融合,实现细菌与不同浓度抗生素的充分反应。
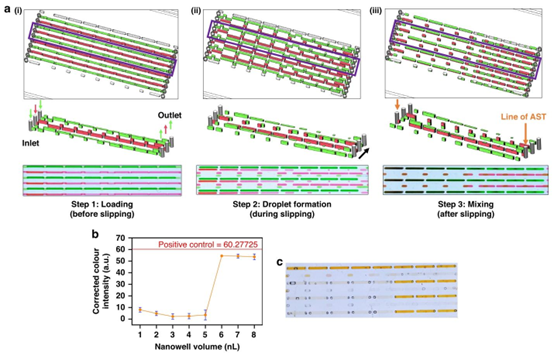
SDFAST芯片工作原理。a 该装置工作原理示意图。红色代表细菌,绿色代表抗生素。紫色框内部分放大以展示每个步骤的细节,并展示每个步骤中彩色染料图案的照片。3D模型使用Blender 4.1构建。b 环丙沙星(CIP)与鲍曼不动杆菌混合的SDFAST结果示例,采用WST – 8检测法。在\(5th\)纳米孔处观察到颜色强度的突然变化(从无色变为橙色),表明此处为最低抑菌浓度(MIC)。c WST – 8检测法的颜色图案照片
该系统采用水溶性四唑盐 – 8(WST-8)显色法作为检测手段,通过颜色强度变化判断细菌生长状态。当抗生素浓度低于最低抑菌浓度(MIC)时,细菌代谢活动使 WST-8 产生橙色显色反应,这种颜色变化可通过 ImageJ 软件进行量化分析,计算校正后的颜色强度值。实验数据显示,在 4 – 6 小时孵育后,颜色强度会出现 abrupt 变化,这一特征成为 MIC 判断的直观依据,相比传统浊度法更易区分微小浓度差异(≤1μg/mL)的样本。
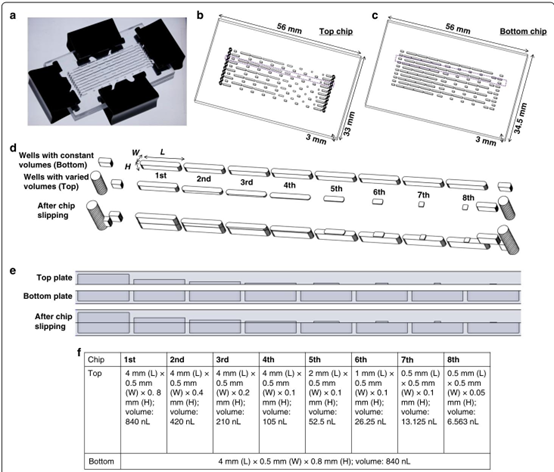
系统内稀释所涉及的尺寸和孔。a SDFAST设备的照片。该设备由b 顶部芯片和c 底部芯片组成。紫色框突出显示了负责系统内稀释的两排孔,如图(d)所示:顶部芯片由从左到右体积逐渐减小的孔组成,而底部芯片由体积恒定的孔组成。滑动过程中,顶部芯片的孔形成体积逐渐减小的液滴,从而稀释溶液。同时,底部芯片的孔形成体积恒定的液滴。滑动后,两个芯片的液滴合并在一起。这一过程在图(e)中进一步展示,即两个芯片的横截面。相应尺寸列于图(f)。3D模型使用Blender 4.1构建。
在稀释机制上,系统通过公式 C₀Vₙ = CₙVₛ 计算各微井的抗生素浓度,其中 Vₛ 为上下液滴融合后的总体积。以初始浓度 10μg/mL 的抗生素为例,经第一级稀释后浓度降至 5μg/mL,稀释因子 D₁ = 2,通过连续计算可获得 8 个梯度的精确浓度,这一过程无需外部泵阀驱动,完全依赖芯片结构实现自稀释,体现了微流控芯片设计中 “结构即功能” 的核心思想。
3. 在抗菌药敏检测中的应用与性能验证
1) 多菌种检测能力
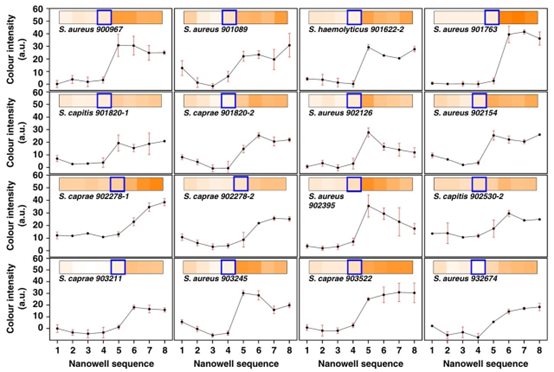
SDFAST 系统对临床常见致病菌展现出广泛适用性。在模型测试中,针对大肠杆菌(E. coli)、鲍曼不动杆菌(A. baumannii)和肺炎克雷伯菌(K. pneumoniae),分别采用头孢他啶(CTZ)、环丙沙星(CIP)和左氧氟沙星(LVX)进行测试,结果显示其 MIC 值与传统肉汤稀释法的偏差均在 2 倍以内。例如,鲍曼不动杆菌对 CTZ 的 SDFAST 检测值为 55.6μg/mL,而传统方法结果为 62.5 – 125μg/mL,证明该系统对革兰氏阴性菌的检测准确性。
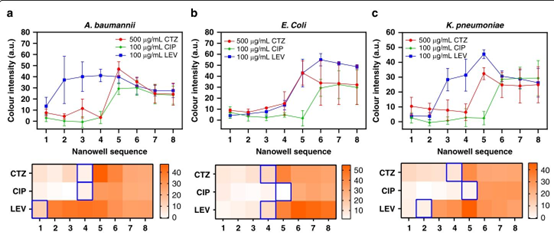
鲍曼不动杆菌(a)、大肠杆菌(b)和肺炎克雷伯菌(c)纳米孔序列中从左至右各孔颜色强度的变化,通过折线图和热图展示。热图中蓝色框所示的突变前的孔代表相应的最低抑菌浓度(MIC)。每种细菌-抗生素组合均进行三次重复试验。
对于葡萄球菌属(包括金黄色葡萄球菌与凝固酶阴性葡萄球菌),系统在 0.19 – 1.5μg/mL 的窄 MIC 范围内仍能保持高精度,16 株已知 MIC 的菌株测试中本质一致性(EA)达到 100%。其中,溶血葡萄球菌 901622 – 2 株的 SDFAST 检测值为 1.56μg/mL,与 E – test 结果 1.5μg/mL 高度吻合,表明其对革兰氏阳性菌同样具有出色的分辨能力。
片上观察到的16种葡萄球菌刺激WST-8颜色模式的热图。每种葡萄球菌 – 万古霉素组合均进行三次重复测试。
2) 临床样本验证
在 51 株临床分离菌的测试中,系统总体本质一致性达到 92%,涵盖葡萄球菌属(MRSA、MRCNS 等)、肠球菌属(VRE 等)及 Nostoc 属等多种微生物。值得注意的是,62.7% 的样本检测值略低于 E – test 结果,这与 E – test 实际操作中倾向于读取椭圆抑菌圈上方数值的习惯有关,而 SDFAST 基于颜色变化的客观判断更接近真实抑菌浓度。这种差异进一步凸显了微流控检测在标准化方面的优势。
4. 微流体芯片技术的优势与未来展望
1) 相比传统方法的突破
与琼脂扩散法、肉汤稀释法等传统 AST 技术相比,SDFAST 系统将检测时间从 16 – 24 小时缩短至 4 – 6 小时,且样本消耗量显著降低,每通道仅需 10 – 20μL 溶液。其颜色 imetric 检测模式无需依赖分光光度计等大型设备,结合智能手机成像与深度学习算法可实现现场快速判读,完美契合 point – of – care testing(POCT)的应用场景。在操作简便性上,通过 Clip 固定与单次滑动即可完成稀释与混合,非专业人员经短期培训即可掌握,克服了传统微流控设备对操作技能的高要求。
2) 技术局限性与改进方向
当前系统存在的主要挑战包括:肠球菌属菌株需要更长孵育时间,推测与微液滴中细菌生长速率降低相关;微型化导致的检测时间延长(宏观 WST – 8 检测仅需 2 – 4 小时)。未来可通过以下改进突破瓶颈:采用虹吸驱动的无泵压力注入系统实现自动化加样;设计推块结构完成芯片自动滑动;集成商用温控模块替代传统培养箱;开发基于智能手机的实时成像与 MIC 计算算法。这些改进思路与器官芯片加工中追求的自动化、集成化理念高度一致。
3) 与其他微流控技术的协同发展
SDFAST 系统的自稀释特性弥补了现有微流控平台的不足。相比依赖扩散的梯度液滴 SlipChip(需 24 小时稀释),其秒级稀释速度大幅提升效率;与集成介电泳的复杂系统相比,简化了操作流程。未来可结合 MEMS 加工中的精密传感技术,开发多参数同步检测芯片;或借鉴 3D 细胞培养芯片的设计理念,构建更接近体内环境的药敏测试模型,进一步拓展其在 antimicrobial resistance(AMR)研究中的应用价值。 微流体芯片技术正通过不断创新推动抗菌药敏检测向快速化、便携化、智能化发展,SDFAST 系统作为其中的典型代表,其结构设计与应用模式为 POCT 领域的微流控器件开发提供了重要参考,有望在遏制抗生素滥用、应对全球 AMR 挑战中发挥关键作用。
© 2025. All Rights Reserved. 苏ICP备2022036544号-1















