参考文献:https://doi.org/10.1038/s41598-025-98304-5
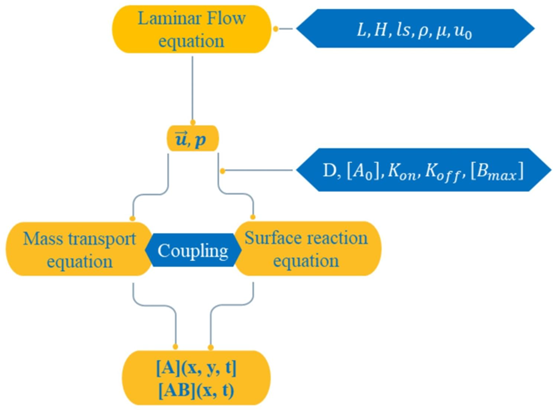
文献以 SARS-CoV-2 快速检测为目标,聚焦微流体芯片的参数优化,其核心在于通过Taguchi 方法与人工神经网络 – 粒子群优化(ANN-PSO) 提升检测效率。研究选取四个关键参数:雷诺数(Re)、达姆科勒数(Da)、施密特数(Sc)及反应表面无量纲位置(X),通过 Taguchi 正交表 L₉(3⁴) 将实验组数从 81 组缩减至 9 组,显著降低了优化成本。
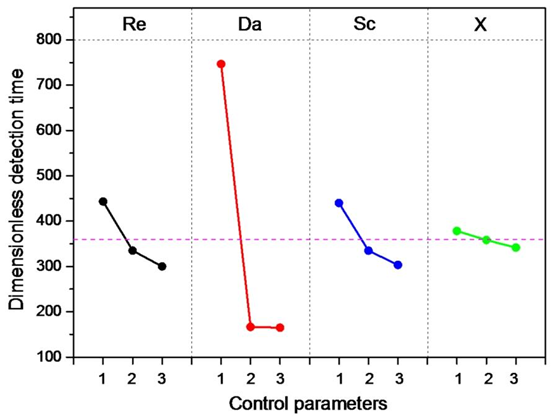
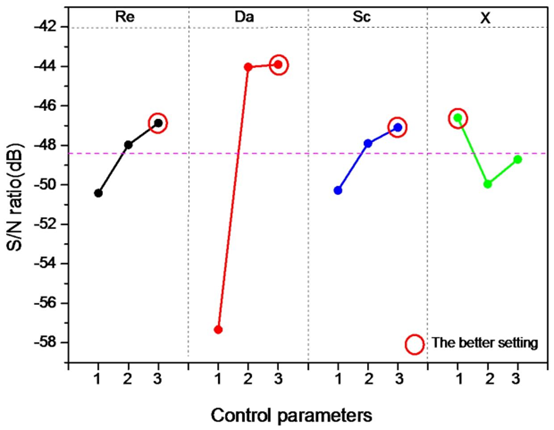
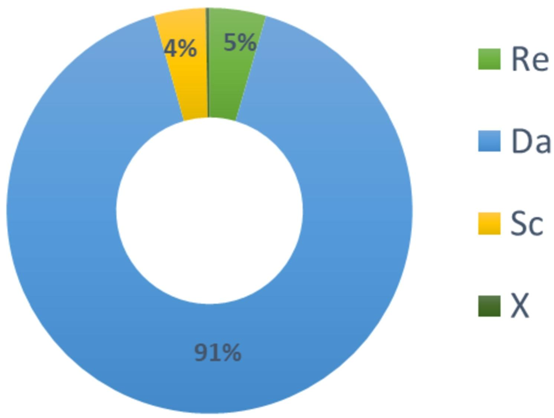
优化结果显示,最佳参数组合为 Re=4×10⁻²、Da=1000、Sc=10⁵、X=1,此时检测时间缩短至 21 分钟,且 Damköhler 数(Da)对微流控芯片效率检测效率的影响占比达 91.1%,成为最关键因素🔶1-5🔶。
1. 芯片核心设计,PDMS 与 MEMS 技术的融合
文献聚焦于用于 SARS-CoV-2 快速检测的微流体芯片优化,其核心设计与加工过程深度依托 PDMS 材料特性与 MEMS 加工技术。芯片的核心结构包括 250μm 长、40μm 高的微通道,以及 20μm 尺寸的反应表面,载体流体为含病毒抗原的水溶液。这类结构的成型依赖 PDMS 浇筑器与光刻胶模具的协同作用,通过精密浇筑与固化工艺实现微通道的微米级精度,这一过程需配合 PDMS 等离子键合机完成芯片的密封,确保流体在通道内无泄漏。
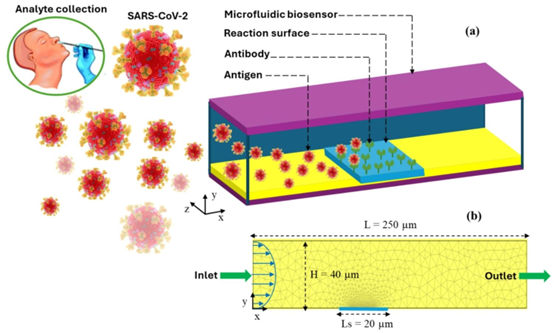
加工精度的控制是技术关键。微通道的几何参数误差需控制在 1% 以内,这依赖电子束光刻技术实现模具的精细刻蚀,属于微纳加工实验室的核心能力范畴。文献中采用有限元法(FEM)进行网格优化,最终选定 1092 个三角形单元的网格模型,既保证计算精度,又降低仿真成本,这一数值仿真环节与 MEMS 加工中对结构性能的预判需求高度契合。此外,反应表面的定位精度(无量纲位置 X=1)需通过 PDMS 对准平台校准,确保抗原流经通道时能与固定化抗体充分接触,避免因位置偏差导致的检测效率下降。
2. 参数优化:Taguchi 方法与流体动力学的协同
为提升检测效率,研究针对四大核心参数展开系统优化:雷诺数(Re)、达姆科勒数(Da)、施密特数(Sc)及反应表面位置(X)。优化过程采用 Taguchi 方法的 L₉(3⁴) 正交表,将原本需 81 组的全因子实验缩减至 9 组,大幅降低了实验成本,同时通过信号 – 噪声比(S/N)与方差分析(ANOVA)精准定位关键影响因素。
1) 达姆科勒数(Da)
作为影响检测效率的首要因素(贡献率 91.1%),其优化值 1000 实现了抗原扩散速率与反应速率的平衡。Da 的物理意义为反应速率与扩散速率的比值,高 Da 值(>1)表明系统为传输限制,更适合 SARS-CoV-2 等大分子抗原的捕获,这与微流控混合芯片中强化传质的设计目标一致。
2) 雷诺数(Re)
优化值 4×10⁻² 确保流体呈层流状态,避免湍流对抗体 – 抗原结合的干扰。低雷诺数下的稳定流场是微流道加工的核心要求,可保障检测结果的重复性。
3) 施密特数(Sc)
取值 10⁵时,动量扩散与质量扩散的平衡促进抗原向反应表面输运。Sc 的本质是流体黏度与扩散系数的比值,高 Sc 值意味着抗原扩散较慢,需通过流场设计强化输运,这与微流控传质强化技术的应用场景高度匹配。
4) 反应表面位置(X)
虽贡献率仅 0.3%,但其精准定位仍需依赖 PDMS 键合对准平台,体现了微流体芯片加工中 “毫米级结构、微米级精度” 的细节要求。
3. 智能算法与检测性能的提升
为进一步提升参数组合的预测精度,研究引入人工神经网络 – 粒子群优化(ANN-PSO)算法。基于 L₈₁(3⁴) 全因子实验的 81 组数据,该算法通过优化神经网络的连接权重,实现了检测时间的高精度预测(R²=0.99,RMSE=33.2),性能优于传统多层感知器(MLP)模型。这种智能优化方法可快速锁定最优参数组合,减少物理实验次数,为微流控芯片的批量生产提供了高效的参数调试工具。
优化后的芯片性能显著提升:检测时间缩短至 21 分钟,较传统 RT-PCR(45 分钟以上)效率提升 53%;检测限(LOD)达 2.197 pmol/L,定量限(LOQ)为 6.659 pmol/L,灵敏度满足临床早期诊断需求。这一性能指标的突破,源于参数优化与智能算法的协同,使芯片在保持低成本(试剂消耗<10μL)的同时,实现了 “样本进 – 结果出” 的即时检测目标。
4. 检测原理:表面修饰与抗原 – 抗体反应的协同
微流体芯片的检测核心是抗原 – 抗体的特异性结合,其效率依赖反应表面的功能化处理。文献中通过氨基化修饰将抗体固定于反应表面,确保抗体的定向排列与活性保持,这一过程与醛基玻片、环氧基修饰的表面功能化原理一致,可减少非特异性吸附,提升反应特异性。
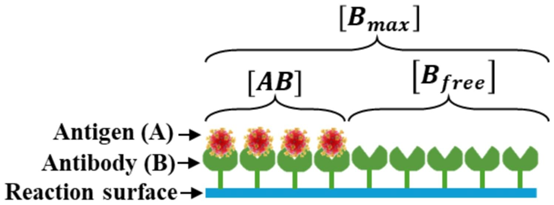
抗原的传输与结合动力学通过耦合方程描述:Navier-Stokes 方程模拟流场分布,Fick 扩散方程计算抗原浓度场,Langmuir-Hinshelwood 模型刻画抗原 – 抗体结合速率。当抗原流经反应表面时,通过扩散与对流双重作用到达抗体结合位点,形成复合物(AB),其浓度达 95% 阈值的时间被定义为检测时间。优化后的流场设计使扩散边界层厚度在饱和时(t=150)显著减薄,加速了复合物的形成,这与微流控浓度梯度芯片中 “薄边界层促反应” 的设计思路相通。
5. 技术扩展:从病毒检测到多场景应用
该微流体芯片的技术框架具有广泛通用性,可扩展至 3D 细胞培养、类器官芯片等领域。其多通道设计(可扩展至 10 通道以上)支持细胞共培养实验,PDMS 材料的生物相容性使其适合微流控细胞培养;而参数优化思路(如 Da 数对传质的调控)可迁移至器官芯片加工,为药物筛选、疾病建模提供平台。
在加工技术层面,PDMS 模具制备、电子束光刻等工艺可直接复用至微流控液滴芯片、微流控 PCR 芯片的生产,体现了微流控加工技术的跨场景适配性。表面修饰技术的扩展(如 PEG 修饰)可进一步降低非特异性吸附,与功能化载玻片的应用形成互补,提升检测灵敏度。 该研究通过流体动力学参数优化 + 智能算法预测,构建了 SARS-CoV-2 检测的 “快速 – 灵敏 – 便携” 三角。其核心创新在于:首次量化 Da 数对结合动力学的主导作用(91.1%),并通过 Taguchi-ANN-PSO 的三级优化,将微流体芯片的检测效率提升至临床可用水平(21 分钟,LOD=2.197 pmol/L)。这一范式不仅适用于新冠检测,更为呼吸道病毒(如流感、RSV)的多靶标集成检测提供了普适性框架。未来,结合芯片表面功能化(如抗体定向固定)与自动化进样模块,有望推动微流体技术从实验室走向社区筛查的 “最后一公里”。
© 2025. All Rights Reserved. 苏ICP备2022036544号-1















