参考文献:《一种用于头颈部肿瘤药物筛选的微流控芯片-张之弥》
研究设计了一种用于头颈部肿瘤药物筛选的微流控芯片,以提高药物筛选的通量和速度。研究通过设计头颈部鳞状细胞癌类器官培养的微小腔室和双通道浓度梯度器,经仿真模拟和实际操作验证,发现该芯片基于对流可产生 6 种不同药物浓度,在 100μL/min 流速下实现稳定药物混合;对肿瘤细胞的活性测试显示,随着药物浓度增加,细胞活性降低,且芯片内外测试结果一致。该研究证实了微流控芯片检测头颈部肿瘤细胞化疗敏感性的可行性,为个性化治疗方案开发提供了技术支撑和理论依据。
1. 芯片核心设计:三维结构与功能分区
1) 分层结构
3 层 PDMS 芯片:中间层为核心功能区,包含 6 个肿瘤细胞培养腔室(直径 6mm,深度 7mm),适配头颈部肿瘤类器官最小培养体积(避免机械损伤导致细胞流失)。
环形弯曲流道:改进自 “圣诞树” 模型,流道宽 200μm、高 100μm,通过螺旋路径增强层流混合效率,缩短药物扩散距离,实现 6 种梯度浓度在腔室均匀分布。
双入口 + 三出口:入口 1 输入药物(如紫杉醇、顺铂),入口 2 输入培养基,出口收集废液,形成闭合循环。
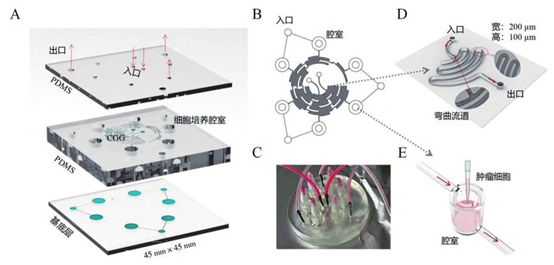
A.分层结构示意图; B. 芯片结构的垂直视图; C. 芯片的实际图像; D. 弯曲流道示意图; E. 细胞培养腔室示意图。
PDMS:聚二甲基硅氧烷,CGG:浓度梯度发生器
2) 材料与制备
PDMS 材质:生物相容性好,紫外消毒 120 分钟以上,表面压痕处理增强细胞贴附(避免悬浮流失)。
SU-8 光刻胶模具:3 层旋涂(2000rpm×30s),热板烘烤(65℃→95℃),紫外曝光 20s,显影后翻模键合,流道厚度精确控制 100μm。
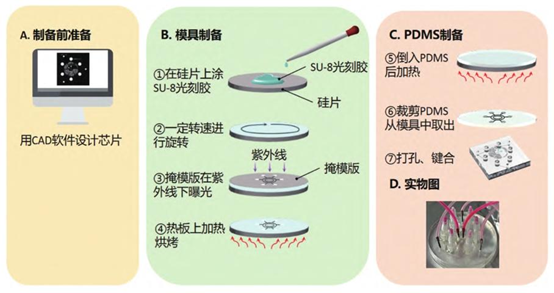
PDMS:聚二甲基硅氧烷
2. 核心功能:梯度浓度生成与动态稳定
1) 浓度梯度原理
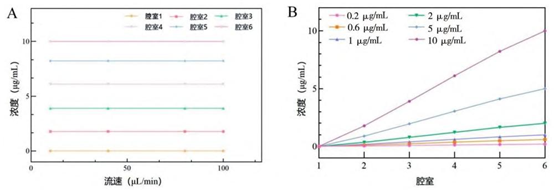
对流主导混合:基于低雷诺数(Re<1)层流特性,药物与培养基在弯曲流道中通过横向扩散混合,形成 6 种梯度浓度(腔室 1-6 浓度百分比:0%、17.8%、39.0%、61.1%、82.2%、100%)。
流速鲁棒性:10-100μL/min 范围内,浓度梯度仅受初始浓度影响(R²>0.99),与流速无关。100μL/min 为临界值,超此流速入口压力过大导致空腔。
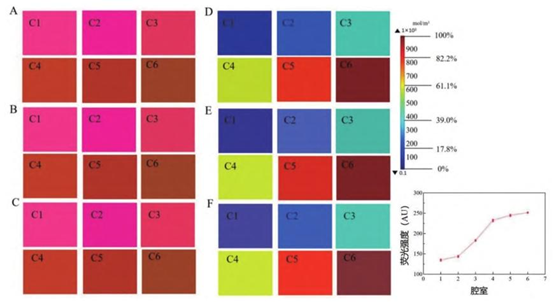
A~ C. 不同流速下的荧光染色状态; D~ F. 不同流速下的模拟效果。
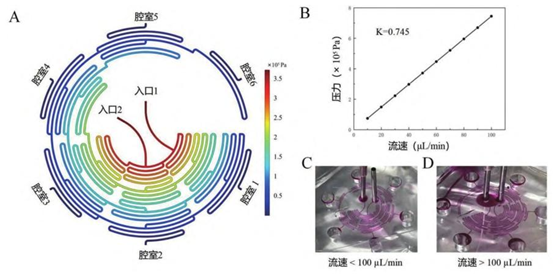
A. 压力变化图; B. 入口流速与对应压力关系示意图; C、D. 流速测试实验图。
2) 稳定性验证
24 小时动态稳定:罗丹明 B 实验显示,腔室浓度 24 小时留存率 > 95%(P>0.05),误差仅 ±10%。
仿真 – 实测吻合:COMSOL 模拟浓度与实验吸光度线性相关,仅 2 个腔室因微结构偏差出现显著差异(P<0.01),整体趋势一致。
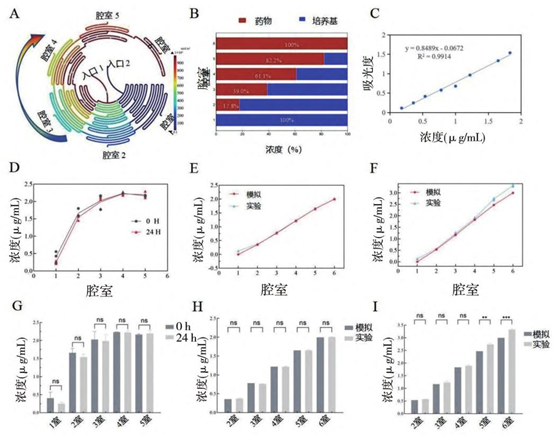
A.装置混合过程; B. 芯片中模拟浓度的比例分布; C. 通过罗丹明 B 溶液测得的浓度与吸光度的关系曲线图; D. 将罗丹明 B溶液和 PBS 通过注射泵持续灌注 24 h,芯片腔室中浓度的变化示意图; E ~ F. 微流控芯片实验结果与模拟结果的浓度值对比;
( G,H,I) 是( D,E,F) 的统计学表示。
ns P>0. 05,∗∗ P<0. 01,∗∗∗ P<0. 001。
PBS:磷酸盐缓冲液
3. 生物学验证:头颈部肿瘤细胞药敏测试
1) 实验模型
CAL-27 细胞:人舌鳞癌细胞,贴壁生长,在芯片腔室中形成 3D 聚集,存活率高于悬浮细胞(如 K562)。
药物选择:紫杉醇(微管抑制剂)和顺铂(DNA 交联剂),覆盖临床一线用药,浓度范围 0-3.3μg/mL(紫杉醇)、0-0.7μg/mL(顺铂)。
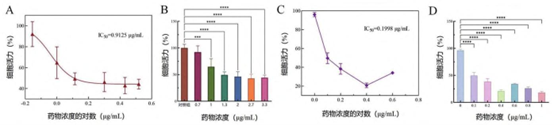
A、B. 紫杉醇; C、D. 顺铂。
∗∗∗∗ P<0. 000 1。
2) 关键结果
剂量依赖性毒性:紫杉醇 2.7μg/mL 时细胞活力降至 57.8%,顺铂 0.7μg/mL 时凋亡率 72.9%。
芯片 – 传统实验一致性:两者细胞活力曲线高度线性相关(R²>0.95),顺铂测试差异更小(P>0.05),可能因贴壁细胞状态更稳定。
实时监测优势:AO/PI 染色直接观察活(绿)/ 死(红)细胞分布,避免传统 CCK8 法的终点破坏性检测。
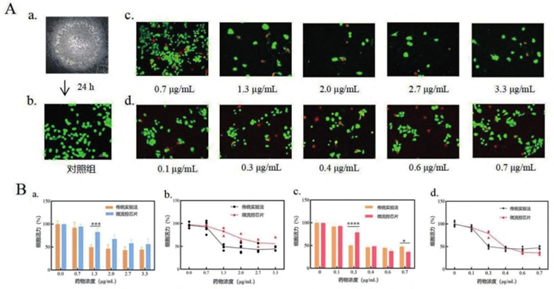
A.芯片中的细胞显微镜图像: a. 置于芯片中的细胞( 明场) ; b. 24 h 后的对照组图像; c. 加入紫杉醇 24 h 后的图像; d. 加入顺铂 24 h 后的图像( 绿色代表活细胞,红色代表死细胞) ; B. 传统实验方法与微流控芯片中细胞活力的比较:不同浓度紫杉醇作用下,两种方法细胞活力变化的柱状图 a 和差异图 b;不同浓度顺铂作用下,两种方法细胞活力变化的柱状图 c 和差异图 d。
误差棒表示均值的标准误差。∗ P<0. 05,∗∗∗ P<0. 001,∗∗∗∗ P<0. 000 1。
4. 创新点与临床价值
1) 技术突破
微型化高通量:单芯片 6 腔室并行,耗材仅为 96 孔板的 1/10,适合临床活检小样本(头颈部肿瘤活检量常 < 100μL)。
动态生理模拟:持续灌注培养基(10μL/min)模拟体内药物代谢,24 小时稳定培养优于静态培养(传统方法需频繁换液,易污染)。
梯度精准控制:初始浓度决定腔室浓度,支持个性化药物浓度定制(如针对耐药患者的高浓度测试)。
2) 临床转化潜力
个体化治疗:通过患者源性肿瘤细胞(PDTC)药敏测试,72 小时内输出最佳药物浓度(传统动物实验需 2-4 周)。
降低毒副作用:芯片预筛可排除低效高毒药物(如顺铂在 0.3μg/mL 以下无效浓度的提前淘汰),减少临床试错成本。
类器官升级空间:未来结合 3D 类器官培养(如基质胶包埋),模拟肿瘤 – 血管互作,弥补 2D 细胞模型的微环境缺失。
该芯片通过三维腔室设计 + 动态梯度生成 + 贴壁细胞培养,突破了传统药敏测试的通量低、微环境失真的瓶颈,为头颈部肿瘤个性化治疗提供了高效工具。其核心价值不仅在于技术创新,更在于将实验室研究与临床需求直接对接—— 用患者自己的肿瘤细胞,在模拟体内环境的芯片上,快速找到 “专属浓度” 的化疗方案。
在针对头颈部肿瘤的药物筛选领域,该微流控芯片展现出显著优势。它借助 PDMS 材质,运用环形弯曲流道设计,实现了浓度梯度的稳定生成,为 3D 培养提供了良好环境,有效提升了细胞活性检测的准确性。芯片制备过程涉及微流控芯片制备等关键技术,从细胞培养腔室的精心设计,到药物浓度梯度的精准生成,每一步都为实现个性化治疗奠定基础。其核心价值在于紧密对接实验室研究与临床需求,利用患者自身肿瘤细胞,快速确定 “专属浓度” 的化疗方案,为临床应用提供了强有力的支持,推动了头颈部肿瘤治疗向精准化迈进。
© 2025. All Rights Reserved. 苏ICP备2022036544号-1















