文章开发了一种非侵入性细胞聚集体减容(PANDA)微流体芯片,采用尺寸分选策略,具有两个入口和两个出口,在≤15Pa的剪切应力下以1L/h通量从100mL全血中成功回收>90%的人工加标HeLa细胞簇,且保持簇完整性,停留时间低于20秒。
参考文献:https://pmc.ncbi.nlm.nih.gov/articles/PMC11515904/
1. 简介
循环肿瘤细胞簇(CTCC)是一类极其稀有但转移性更强、与较差临床结果相关的细胞群,从血液中高效分离它们对于早期癌症诊断和个性化治疗具有重要意义。
传统的离心方法在处理CTCC时存在产量低和细胞损伤问题,而现有微流体技术受限于剪切应力高、处理量小和血液稀释等问题,尚无法实现对未稀释全血中CTCC的高产量、连续、低剪切应力分离。
为此,文章开发了一种非侵入性细胞聚集体减容(PANDA)微流体芯片,采用尺寸分选策略,具有两个入口和两个出口,在≤15Pa的剪切应力下以1L/h通量从100mL全血中成功回收>90%的人工加标HeLa细胞簇,且保持簇完整性,停留时间低于20秒。
该设备在几乎无损地返回>99.9%血液成分的同时,仅需极少量稀释液,展现出在临床上实现高效获取CTCC的巨大潜力。
2. 结果
1) PANDA芯片设计
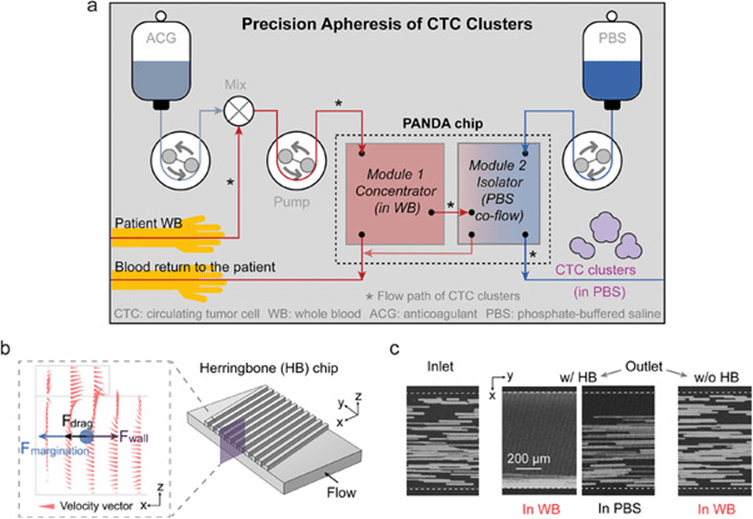
文章希望实现CTCC的精准单采流程:从患者体内抽取血液,与抗凝剂混合后,经微流体装置将CTCC分离至PBS中,并将其余血液安全返回体内。
该装置需实现高通量、低剪切应力(≤15Pa)下的连续分离,同时避免CTCC损伤或丢失,并防止血液成分激活或过度稀释。
为降低堵塞风险,最小通道深度设为100µm。
采用非标记的尺寸分选策略,结合两个模块:模块1为“浓缩器”,在未稀释全血中高效富集CTCC;模块2为“隔离器”,通过缓冲液稀释后使用非平衡惯性分离阵列(NISA)技术,将CTCC从稀释血液中分离至干净的缓冲液中。
关键在于利用边缘效应:红细胞集中于管中心,将较大的CTCC推向管壁,再结合人字形结构引发的二次横向流动,使CTCC在血液中有效聚焦。
实验表明,HeLa细胞在含人字形层的通道中能在全血中实现良好聚焦,而在PBS中或无该结构的通道中聚焦效果明显减弱,证明边缘化与二次流的协同作用对分选至关重要。
2) 单级浓缩器的优化
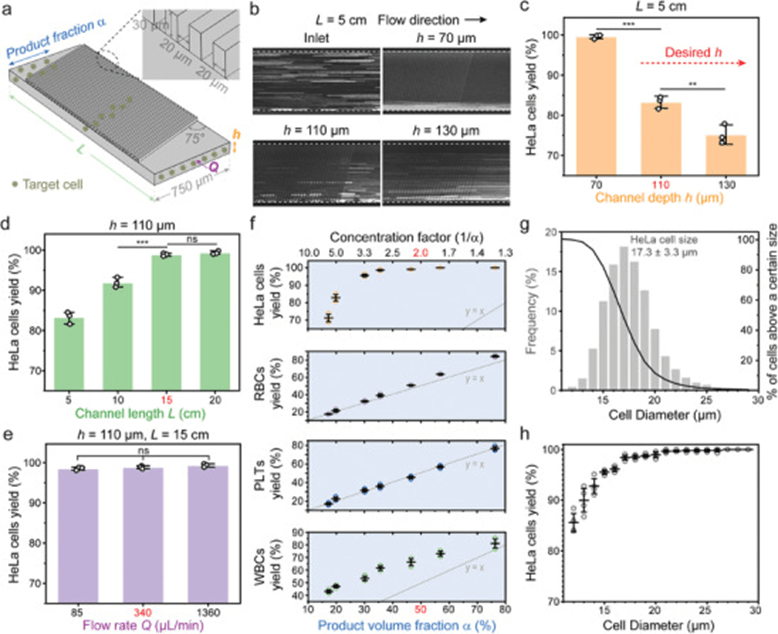
文章首先对单级浓缩器进行了优化,发现较窄的人字形凹槽(20µm宽、20µm间距、75°倾角)可有效防止HeLa细胞进入凹槽,提升聚焦效果。
随后评估通道参数对分选性能的影响,结果表明较大的通道深度(>100µm)虽能减少堵塞风险,但会降低聚焦程度;通过延长通道长度至15cm可恢复HeLa细胞产量至99.1%。
此外,HeLa细胞聚焦与流速无关,证实惯性力非主导机制。
在产物体积分数调控下,低于3倍浓缩仍保持>95%产量,但在5.7倍浓缩时产量降至71%;同时,大尺寸白细胞随浓缩倍数增加而富集,而血小板浓度基本不变。
为平衡产量和并行化操作,文章选择2倍浓缩。
基于尺寸分布分析,浓缩器对15µm及以上细胞分选效率高(15µm产量为95.5%,>19µm为99%以上),在MDA-MB-231和MGH-BRx-142细胞系中均验证了高回收率(93.3–99.7%),并在不同血细胞比容(HCT)条件下保持稳定产量(≈99%),证明该系统适用于不同抗凝血样的高效CTCC浓缩。
3) 集群芯片与三级聚光器的集成
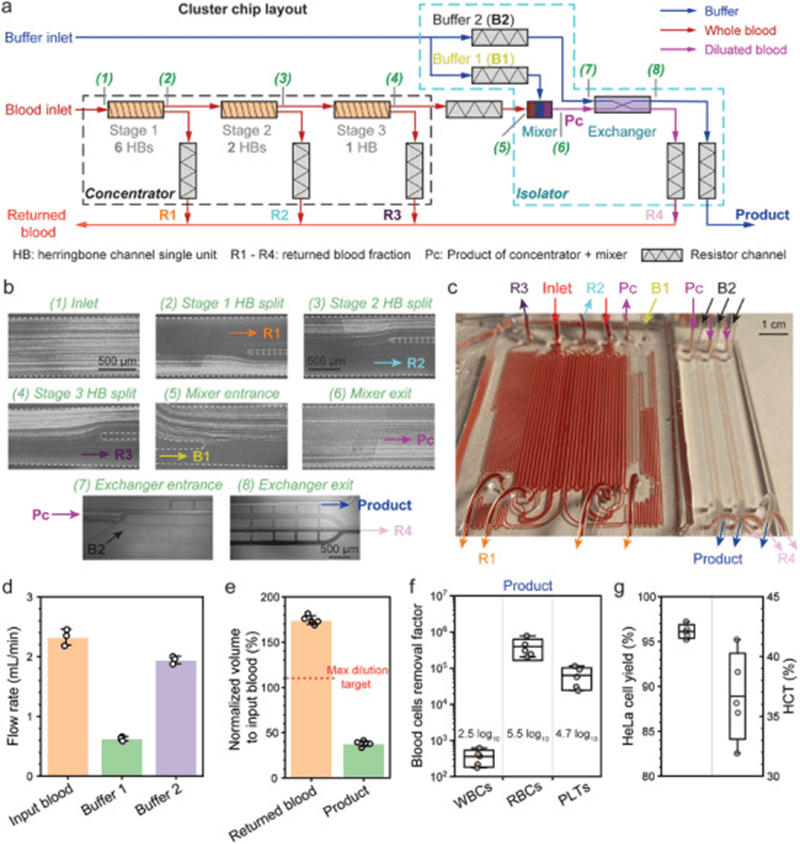
在优化单级浓缩器后,文章开发了集成三级浓缩器和隔离器的集群芯片,实现将HeLa细胞从全血中高效分选至PBS中。
芯片采用六个并行1级通道、两个2级通道和一个3级通道逐步浓缩CTCC,然后通过混合器将产物以1:5比例稀释,降低粘度并维持一致的分离条件,最终进入基于NISA技术的交换器。
交换器利用尺寸依赖的惯性壁升力,将大尺寸HeLa细胞从矩形岛结构壁面推出,并通过100µm间隙排出小尺寸血细胞,实现有效分离。
为避免PDMS材料在压力下变形,文章使用刚性环氧树脂制造芯片,即便在高达80psi压力下也未见泄漏。
显微成像确认了HeLa细胞在三级浓缩器中的持续聚焦,并成功被转移至PBS中,细胞回收率达96.1%,在35.3%–43.1%HCT范围内性能稳定。
同时,血液中WBC、RBC和PLT的去除率分别达2.5、5.5和4.7log₁₀。
输入血液、缓冲液1和缓冲液2的流速分别为2.3、0.6和1.9mL/min,在恒定剪切应力条件下实现稳定操作。
20mL输入血液在10分钟内处理完成,产出38%体积的产品和174%体积的回流血液,尽管回流量超标(目标为110%),表明仍需更多级浓缩,但整体系统已展示出从原始血样中高效分选CTCC的可行性与强大集成性能。
4) 使用六级浓缩器减少回输血液的稀释
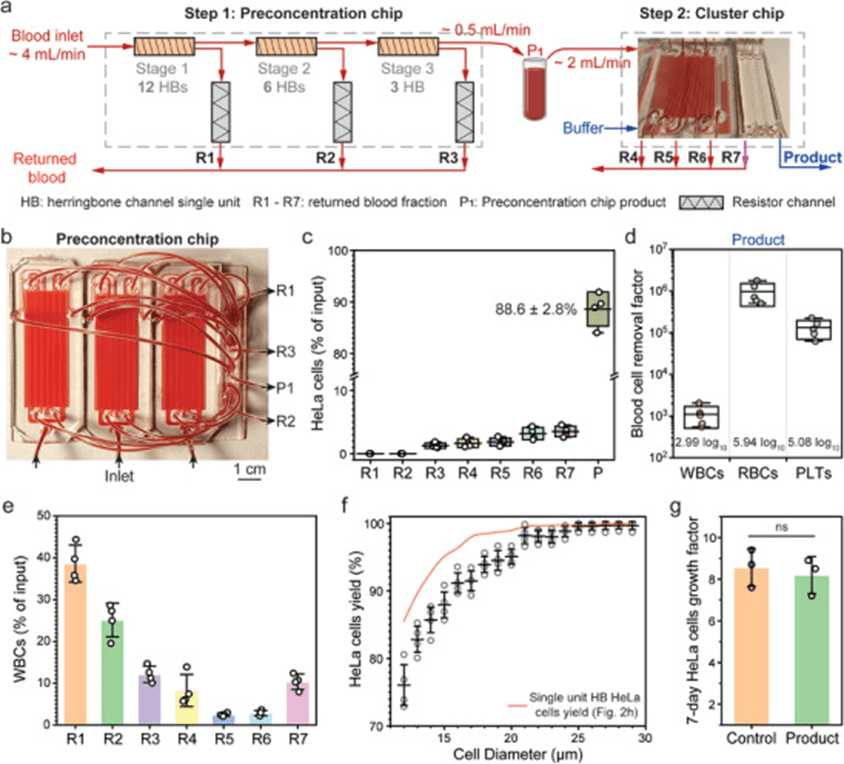
为进一步减少回流血液稀释并提高处理能力,文章将浓缩级数从三级扩展至六级,设计了包含12、6和3个并行通道的三级预浓缩芯片,并与集群芯片串联运行。
在15Pa剪切应力下,预浓缩芯片输入和产品流速分别为4和0.5mL/min,产品随后以2mL/min速度送入集群芯片处理,整个流程可在30分钟内完成100mL血液的处理。
HeLa细胞总体回收率达88.6%,虽R1和R2几乎无细胞损失,但R3至R7分别产生1.2%至3.5%的递增损失,推测由白细胞过度拥挤引发HeLa细胞失焦。
相比单独的集群芯片,组合系统对WBC、RBC和PLT的去除效率更高,分别达3、5.9和5log₁₀,血液成分的返回率超过99.9%。
R1至R6中返回了89.7%的白细胞,总体积占输入血液的98.1%,若排除R7,仅损失1.9%体积(即每升血液损失19mL),实现接近无稀释的回流。
虽然六级浓缩对细胞大小相关产量略有影响,15µm细胞回收率降至88%,但分选后的HeLa细胞仍表现出良好的活力和生物功能,其在7天内生长8.2倍,且划痕实验显示迁移能力与未处理组无差异,说明微流控过程对细胞生物学特性无显著影响。
5) 输血性质评估
为评估微流控分选是否影响体外血液性质,文章对分选前后(结合R1至R7)血液进行了系统分析。
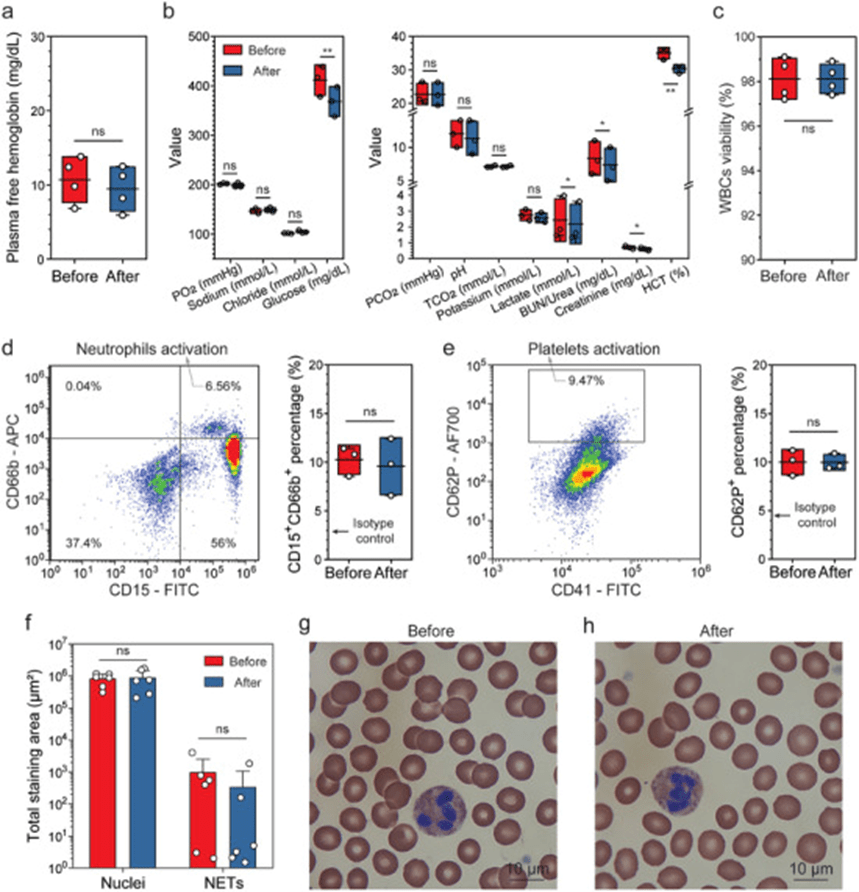
结果显示,血浆游离血红蛋白浓度无显著变化,表明溶血极小;血液化学测试(CHEM8+、CG4+)中,由于R7中PBS稀释作用,葡萄糖、乳酸、尿素、肌酐和血细胞比容浓度约降低10%,但气体指标(pH、CO₂、O₂)及钠、钾、氯离子保持稳定,该稀释可通过不返回R7避免。
在细胞层面,白细胞活力未变,流式细胞术显示中性粒细胞(CD15⁺CD66b⁺)和血小板(CD41⁺CD62P⁺)活化水平无差异;NETs(中性粒细胞胞外陷阱)未增加。
瑞氏-姬姆萨染色显示红细胞形态正常,直径和圆度在分选前后差异不显著,中性粒细胞和单核细胞结构保持一致。
由于分选过程中剪切应力低(<15Pa)且停留时间短(<20s),微流控操作对血液性质影响极小。
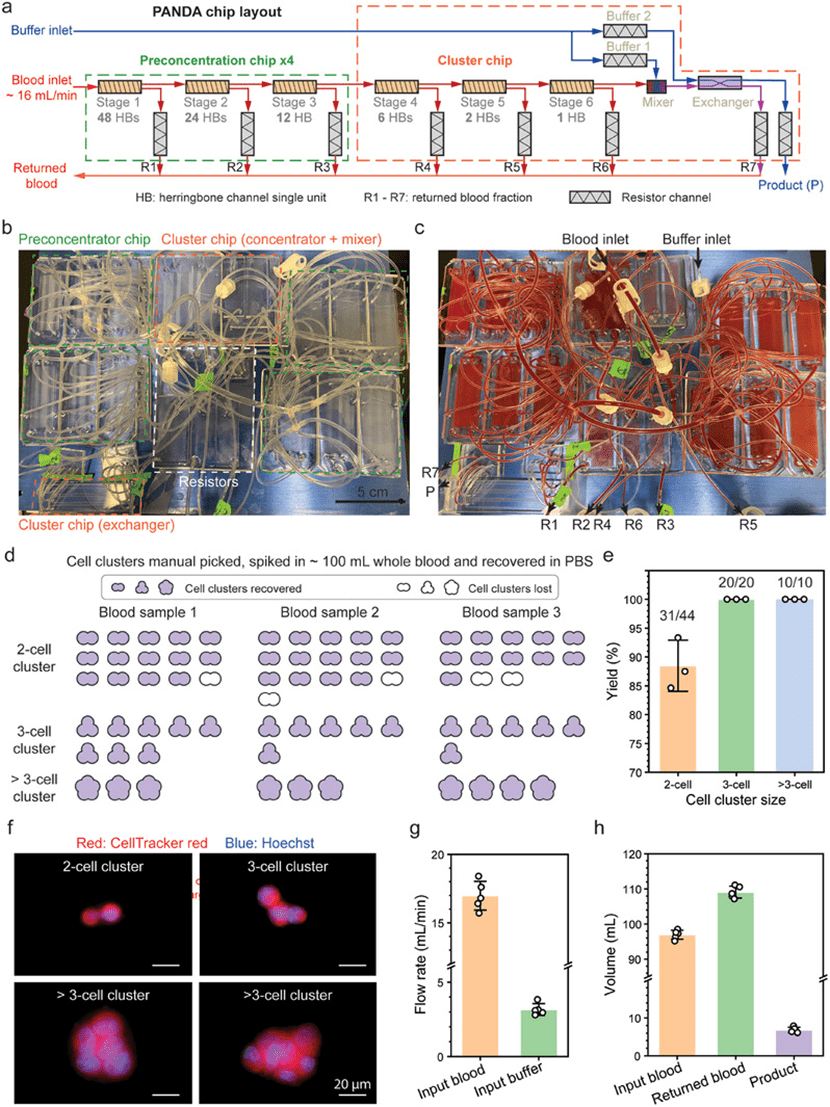
6) 全血中加标稀有细胞簇的连续回收
为验证在高通量条件下连续回收稀有细胞簇的能力,文章设计了集成四个预浓缩芯片和一个簇芯片的PANDA芯片系统,在电阻通道R1至R6中将最大剪切应力提高至50Pa,其余通道维持在15Pa,以在不增加设备体积的前提下提升处理效率。
该设计实现了连续分选,避免了传统两步法中细胞簇在转移过程中的损失。
文章在约100mL未稀释血液中加入约24个HeLa细胞簇,评估其回收率,结果显示:2、3和>3细胞簇的回收率分别为88.5%、100%和100%,且回收细胞簇在大小和形态上具有多样性,验证了系统的鲁棒性。
在输入血液和缓冲液流速分别为17±0.9和3.2±0.3mL/min的条件下,系统吞吐量约为1L/h,100mL血液可在6分钟内完成处理。
回输血液量增加约12.5%,产物减少至6.8mL,系统内总血液体积为1.4mL。
© 2025. All Rights Reserved. 苏ICP备2022036544号-1















