文章提出了一种名为液滴细胞钳(DCP)的微流控基因递送平台,结合液滴微流控与细胞机械穿孔技术,通过微尺度收缩在细胞膜和核膜上产生不连续性,从而实现CRISPR系统的高效内化。
DCP成功递送多种大分子(如mRNA达98%、质粒DNA达91%),展现出良好的多功能性。
在基因编辑方面,DCP在单敲除、双敲除和基因敲入效率上分别是电穿孔的约6.5倍、3.8倍和3.8倍,显著优于现有技术,展现出其作为下一代CRISPR基因编辑工具的广阔应用前景。
参考文献:https://pmc.ncbi.nlm.nih.gov/articles/PMC11405868/
1. 器件特性
本研究开发了一种基于液滴细胞机械穿孔(DCP)原理的高效细胞内递送平台,通过结合液滴微流控和物理细胞穿孔技术,显著提升了基因递送的效率与通量。
该平台首先在上游利用流动聚焦结构稳定生成包裹细胞和生物分子的液滴,再通过下游单一收缩通道在高速流动下瞬时诱导细胞膜通透性,从而实现高效递送。
相比传统的多收缩结构液滴细胞挤压方法,该设计有效避免通道堵塞问题,并显著提高了CRISPR等大分子系统的传递效果。
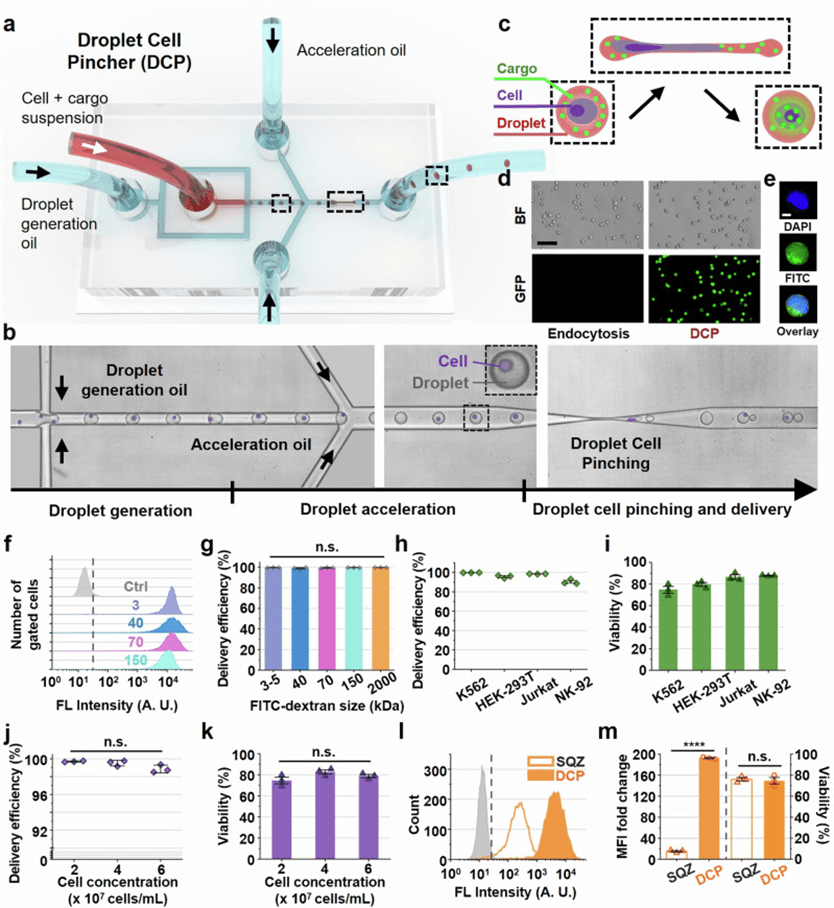
在验证实验中,DCP 成功将 FITC 标记的不同分子量葡聚糖高效递送至 K562 等多种细胞中,递送效率接近100%,且细胞活力保持在75%以上。
同时,该平台在高细胞密度(高达6×10⁷ cells/mL)下仍保持稳定运行,显示出良好的可扩展性,适合用于如CAR-T等细胞治疗的大规模应用。
与代表性的细胞挤压法对比,DCP显示出显著更高的分子递送能力(MFI提高近13倍),主要归因于液滴中的高分析物浓度及其引导的对流内化机制。
2. 优化设备运行
为优化DCP平台的递送性能,文章系统评估了流体动力学参数和微通道几何结构对递送效率、MFI倍数变化和细胞活力的影响。
在固定上游液滴生成条件和细胞密度(2 × 10⁷ cells/mL)下,文章以2000 kDa FITC-葡聚糖为模型货物,改变下游油鞘流速(0–1.5 mL/h)进行实验。
结果显示,所有条件下递送效率均接近100%,但MFI倍数变化随油鞘流速上升而增强,在1.0 mL/h时达到最优,同时维持较高的细胞活力。
进一步引入以MFI倍数变化与细胞活力乘积定义的综合指标,确认1.0 mL/h为最佳流速。
在几何参数方面,文章保持收缩长度为70 μm,分别测试了6、8 和10 μm的收缩间隙宽度。
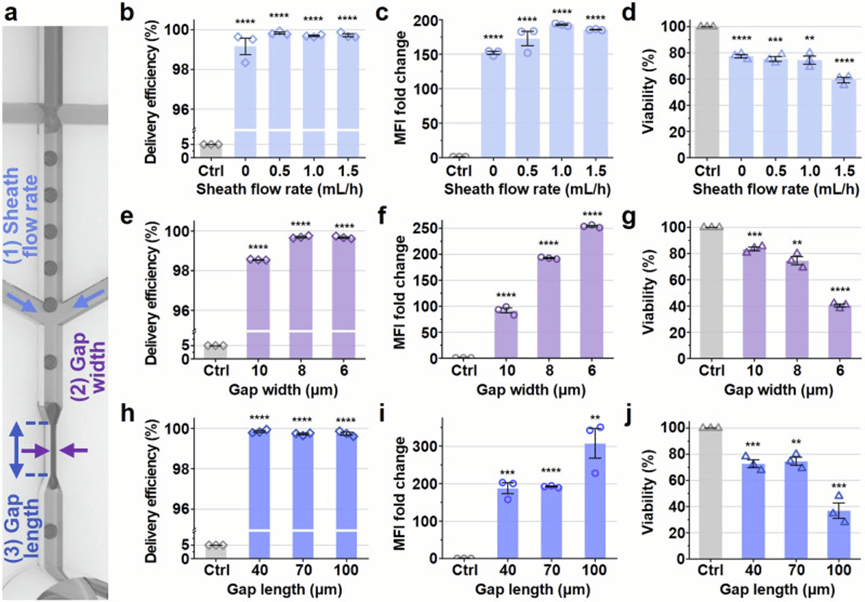
虽然较窄的间隙增强了MFI,但也导致细胞活力下降,最终确定8 μm为最优宽度。
随后将宽度固定为8 μm,测试收缩长度对递送表现的影响。
虽然100 μm长度产生最高的MFI倍数变化,但显著降低细胞活力;而70 μm在保持高递送水平的同时兼顾细胞生存率,被认为是最佳长度。
因此,结合以上结果,文章确定DCP平台的最优操作参数为:下游油鞘流速1.0 mL/h,收缩宽度8 μm,收缩长度70 μm。
在此条件下,平台在实现高递送效率的同时最大程度保持细胞活性,后续所有生物分子递送实验均基于此优化方案进行。
3. 通过 DCP 进行功能性生物分子的细胞内递送
为评估DCP平台在FITC-葡聚糖以外的递送应用潜力,文章进一步探索其将功能性生物分子(如eGFP编码的mRNA和GFP编码的pDNA)内化至K562细胞的能力。
在先前优化的操作条件下(流速1.0 mL/h,收缩宽度8 μm,长度70 μm),文章首先将996核苷酸的eGFP-mRNA(2 μg/mL)递送至细胞内,观察到强烈且均匀的荧光表达,而未处理组几乎无信号。
随后,通过流式细胞术定量分析不同mRNA浓度(0.2、2 和 20 μg/mL)的转染效果。
结果显示,DCP平台在2 μg/mL时已实现约99%的转染效率,MFI倍数变化达47倍,而在20 μg/mL时更是达到了726.1倍,表现优于文献中在更高剂量下的转染平台。
进一步,文章递送不同大小(4.1–9.1 kbp)的GFP编码pDNA至K562细胞。
尽管pDNA递送面临更高挑战(需穿越核膜,分子更大),DCP平台依然展现良好表现,尤其在7.9 kbp的pDNA递送中观察到明显荧光。
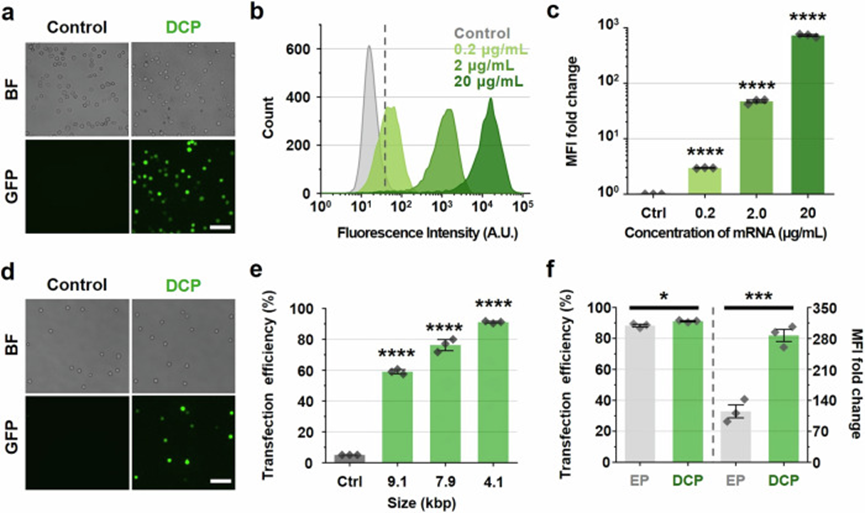
在50 μg/mL浓度下,虽大分子pDNA转染效率下降,但仍显著优于传统基于细胞挤压的微流体平台。
为对比DCP与电穿孔,文章对4.1 kbp pDNA进行平行转染实验,发现尽管两者转染效率相近,DCP平台的MFI倍数变化(286.7倍)远超电穿孔(115倍)。
另外细胞形态分析显示,电穿孔对细胞形状影响更大,而DCP平台处理后细胞形态保持更好,支持其在保持细胞功能方面更具优势。
4. CRISPR–Cas9 介导的基因组编辑
本研究展示了DCP微流控平台在CRISPR-Cas9介导的基因组编辑中的高效能与多功能性。
通过将CRISPR-Cas9 RNP精确递送至K562细胞核内,平台实现了超过50%的基因敲除效率,显著优于电穿孔(7.6%)和脂质转染(1.3%),并通过T7E1和NGS分析进一步证实。
在多重编辑实验中,DCP通过递送两个RNP靶向不同EMX1位点,实现了双敲除,编辑效率是电穿孔的3.8倍。
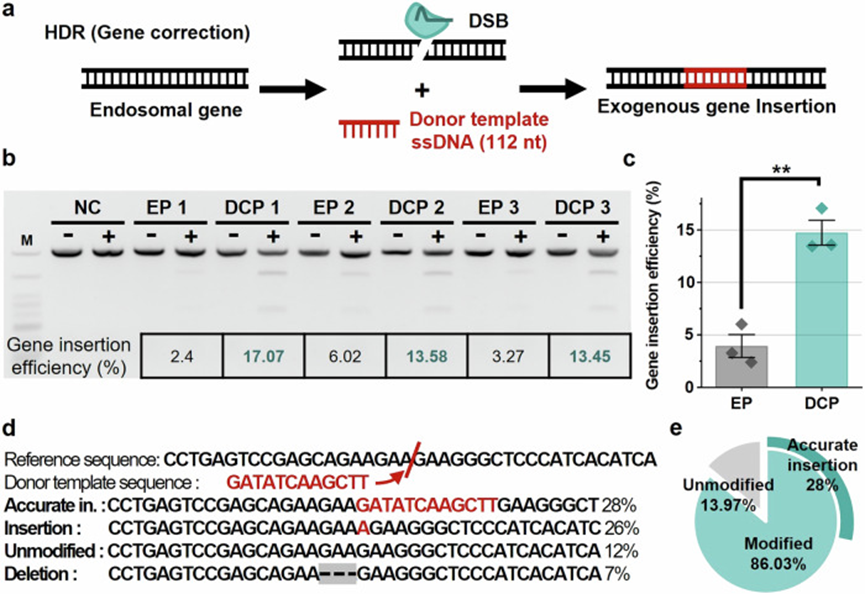
还通过引入HDR供体模板,DCP平台实现了14.7%的基因敲入效率,亦远高于电穿孔(3.9%),且NGS显示有28%为精准插入。
平台利用液滴内的二次流与高速细胞机械穿孔,实现对大分子(如RNP、mRNA和pDNA)的高效内化,编辑效率优于传统方法,且细胞形态维持更稳定。
尽管需要破乳步骤,但可通过自动化解决,仍具低堵塞、高通量、低耗材、高细胞活力和成本优势。
站内搜索
© 2025. All Rights Reserved. 苏ICP备2022036544号-1















