本文描述了一种微流控装置,该装置集成了 3D 细胞培养和基于液滴的生物分析模块,用于对细胞培养基进行采样和分析。该装置用于肝培养中的激素刺激和葡萄糖代谢测量。
参考文献:https://pmc.ncbi.nlm.nih.gov/articles/PMC10916504/
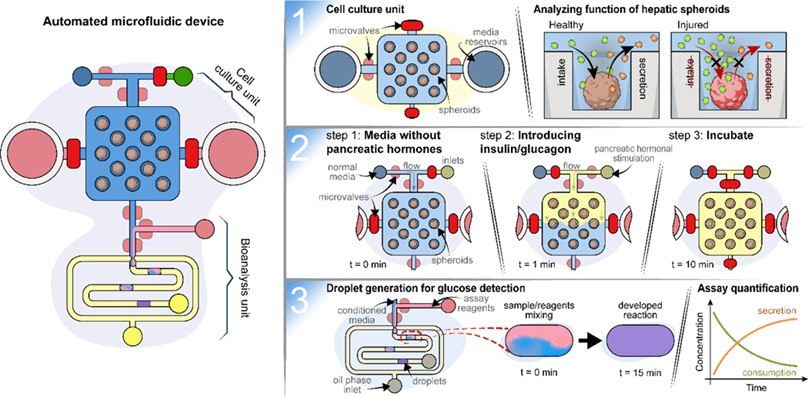
1. 微流体装置的设计和工作原理
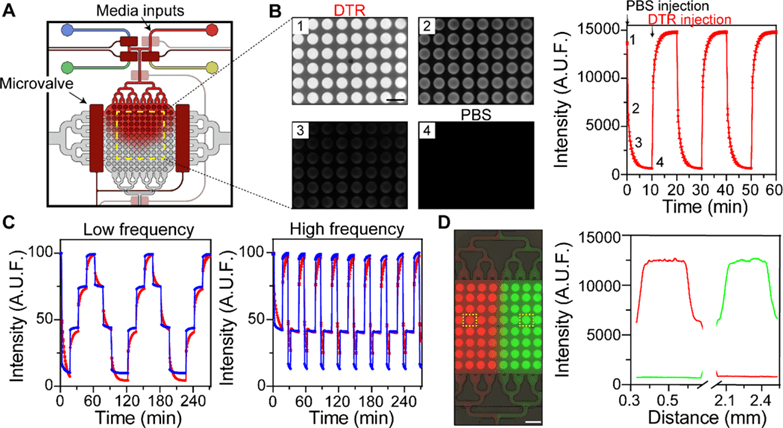
本文介绍了一种集成化微流体装置,包含140个用于3D细胞培养的微孔阵列及液滴生成器,实现了培养基采样与分析的自动化整合。
该装置内建微型阀门,支持四种功能:调控培养基成分、采样期间隔离培养室、使培养基与分析试剂共流,以及液滴生成。
液滴通过培养基与试剂以1:1比例(38.8 μL/min)共流生成,体积可通过微阀控制,精确至0.4–1.4 nL;本研究使用约0.8 nL液滴。
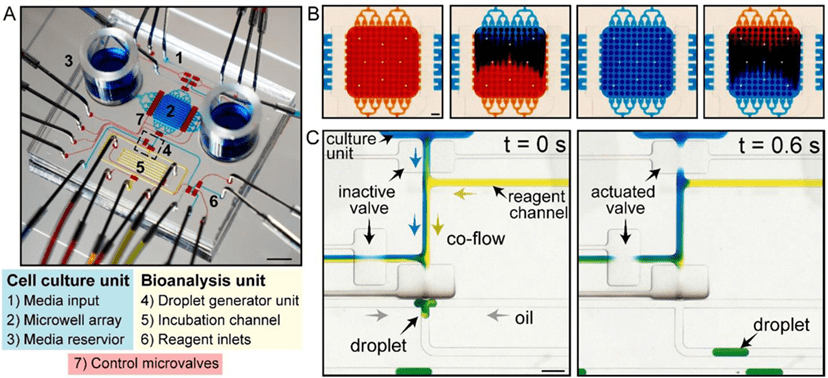
液滴生成后被暂存于孵育通道以进行酶促或免疫分析。
与先前通过管道连接的双装置系统相比,本文所开发的整体式装置大幅减少了分析物在采样过程中的稀释。
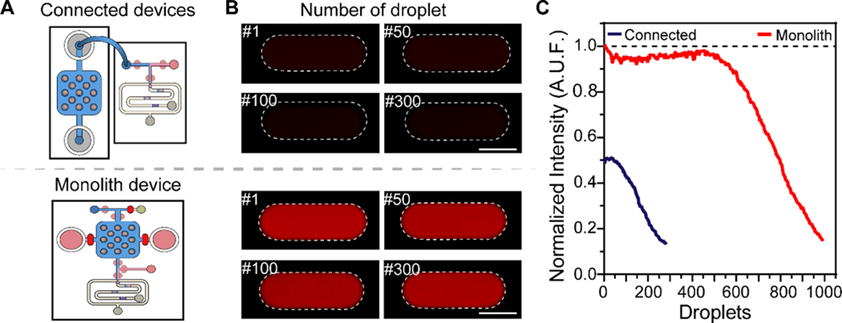
在对模型荧光分析物DTR的实验中,单体装置生成的液滴荧光信号更强且稳定性高(达500个液滴),而连接系统则出现显著稀释。
装置还可动态切换四种培养基输入,通过自动化微阀控制交换频率与成分,10分钟内完成切换,实现区域特异性刺激。
最终,作者利用该装置对肝细胞施加胰岛素与胰高血糖素刺激,并同步分析葡萄糖代谢,展现了该平台在复杂化学刺激与实时生物分析中的潜力。
2. 表征液滴内葡萄糖和白蛋白的分析
本研究旨在探究正常与受损肝细胞对胰岛素和胰高血糖素等胰腺激素刺激的反应,特别关注葡萄糖代谢与白蛋白合成等关键生理指标。
为此,作者开发并优化了一种可在微流控装置中检测葡萄糖和白蛋白的片上液滴分析方法。
针对葡萄糖检测,作者在商业酶促测定基础上提升了HRP和ADOS浓度,以增强吸光信号,并在液滴中实现0–10 mM范围内的定量检测,检测限为0.034 mM,孵育时间仅需5分钟。
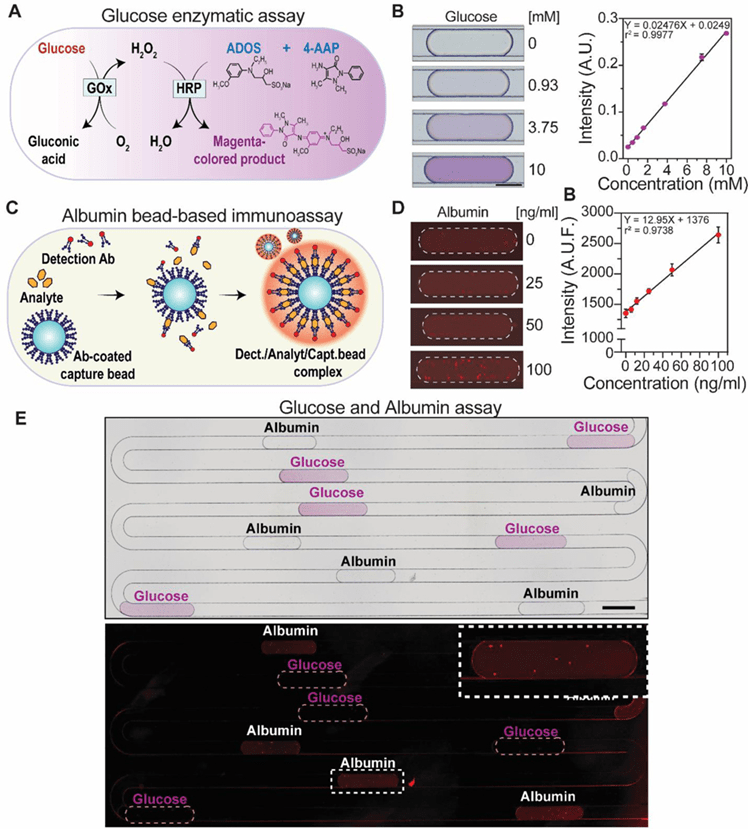
高时间分辨率实验表明,该系统可实现每分钟生成液滴并在1分钟内产生可检测信号。
为检测白蛋白,作者设计了基于微珠的一步法荧光免疫分析,利用检测抗体在分析物存在下组装于微珠表面产生荧光,实现了8.2–100 ng/mL的检测范围。
进一步地,作者展示了装置可在交替生成的液滴中同步检测两种分析物:将酶促试剂与葡萄糖、微珠免疫试剂与白蛋白分别混合,通过液滴依次生成实现交替信号读出(见Figure 5E)。
目前系统支持三种不同检测试剂的并行检测,未来通过设计优化有望拓展至更多分析物。
3. 表征肝细胞激素刺激后葡萄糖代谢的变化
本研究利用自动化微流体装置研究肝细胞对胰腺激素胰岛素和胰高血糖素的反应,模拟进食与禁食周期中的葡萄糖代谢动态。
该装置不仅支持3D肝细胞球体的快速培养,还可在激素刺激下高频率采样培养基,实时监测细胞代谢。
HepG2 肝细胞接种后2天内在微孔中形成球体,并保留响应胰腺激素的能力。
激素刺激实验在接种5天后进行,通过每2小时采样分析葡萄糖水平,发现未刺激时葡萄糖在前6小时快速下降(1.25 mM/h),后期下降速率减缓,可能反映代谢途径的转变。
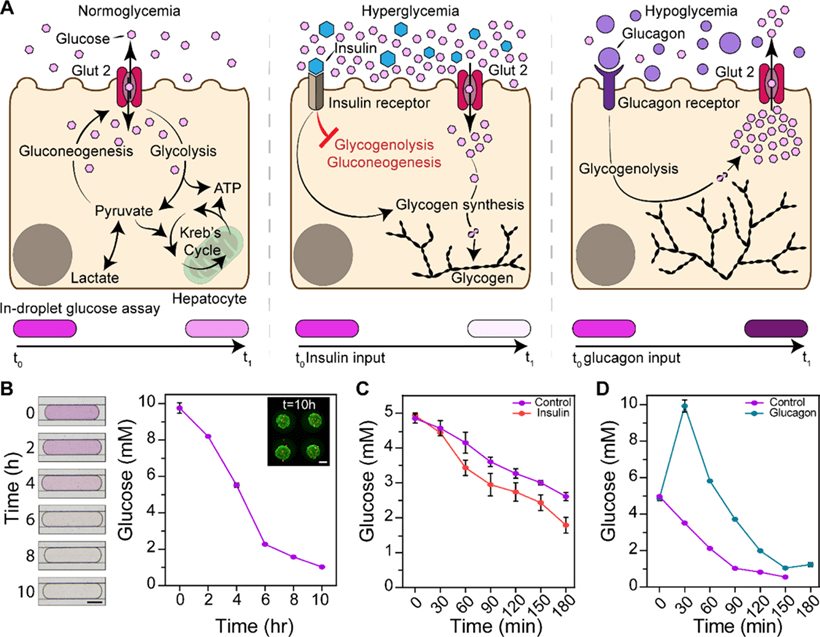
模拟进食前状态后,添加胰岛素可显著提高细胞的葡萄糖消耗速率,尽管反应有约30分钟延迟。
为模拟禁食状态,向肝球体加入胰高血糖素,结果显示细胞在刺激后30分钟内迅速分泌葡萄糖,随后葡萄糖水平下降,显示再摄取现象。
该反应在不同浓度的胰高血糖素刺激下均可观察,符合文献报道的激素反应模式。
本研究展示了该微流体系统在动态监测肝脏对激素刺激反应方面的高时间分辨率与多功能性,反映了胰腺–肝脏之间复杂的代谢调控机制。
4. 评估脂毒性损伤对肝细胞激素反应的影响
本研究利用微流体装置探讨了脂毒性对肝脏胰岛素反应的影响,以模拟非酒精性脂肪性肝炎(NASH)相关的病理机制。
作者将肝细胞暴露于棕榈酸(PA)中48小时,以诱导脂质负荷和细胞损伤。
通过LDH释放、活/死染色和油红O染色评估细胞毒性和脂质积累,结果显示细胞虽受中度损伤,但仍具活力并维持白蛋白合成功能。
在胰岛素刺激实验中,与健康对照相比,PA处理的肝细胞在胰岛素存在下未表现出葡萄糖消耗,显示出明显的胰岛素抵抗。
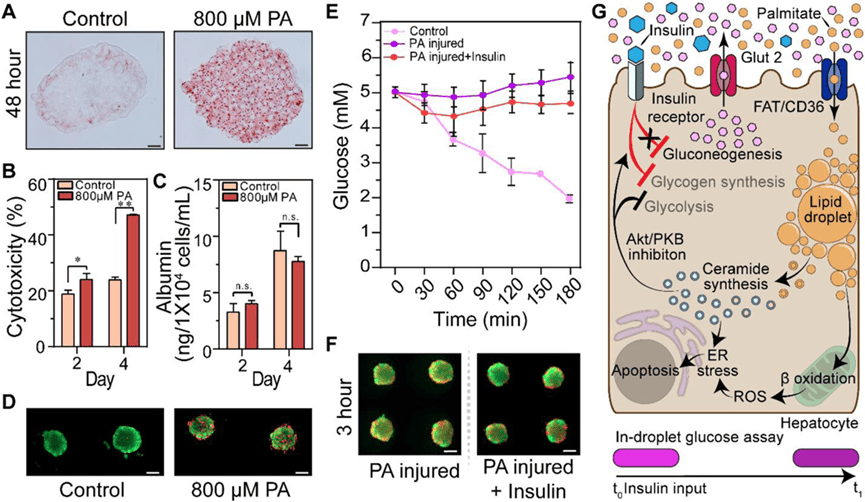
尽管这些球体仍然存活并具有分泌功能,但它们未能响应胰岛素,这表明其可能已切换至其他能量代谢方式,如脂肪酸氧化。
有其他文献报道棕榈酸可在肝细胞中转化为神经酰胺,抑制Akt/PKB通路,从而阻断糖酵解与糖原合成。
综上,上图总结了脂毒性如何导致肝细胞对胰岛素反应下降,模拟了NASH与2型糖尿病之间的代谢关联,为理解胰腺–肝脏串扰提供了体外模型支持。
© 2025. All Rights Reserved. 苏ICP备2022036544号-1