参考文献:Microfluidic single-cell technology in immunology and antibody screening – ScienceDirect
文章重点介绍微流体技术在免疫学中的四个主要应用:
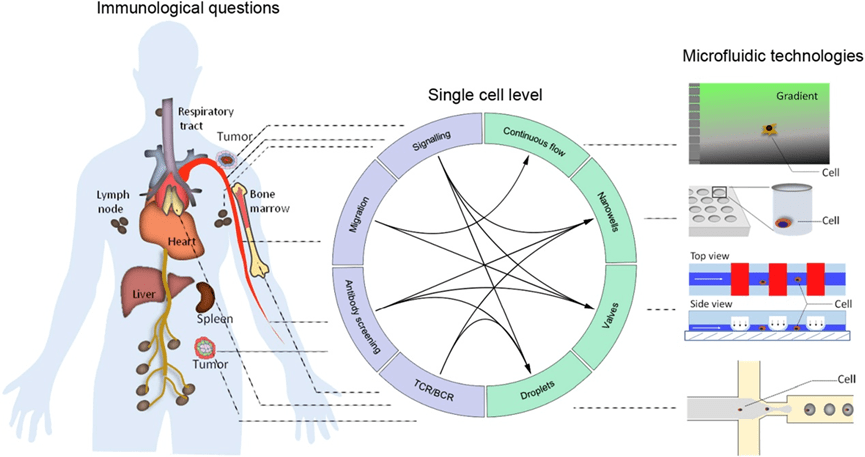
一,在免疫信号传导研究中,微流体系统可实现对免疫细胞的高时空控制,精确递送刺激试剂并进行细胞配对,同时采集多参数定量数据以揭示分子机制;
二,在免疫细胞迁移研究中,微流体可生成可控的稳定梯度,便于分析趋化行为及迁移相关因素;
三,可通过液滴或阀门系统对单个细胞进行小体积分析,实现对分泌抗体(如IgG)细胞的表型筛选;
四,微流体技术可将单个B细胞或T细胞区室化,并以高通量方式扩增特定基因或转录组,用于免疫球蛋白基因的配对测序和细胞库筛选。
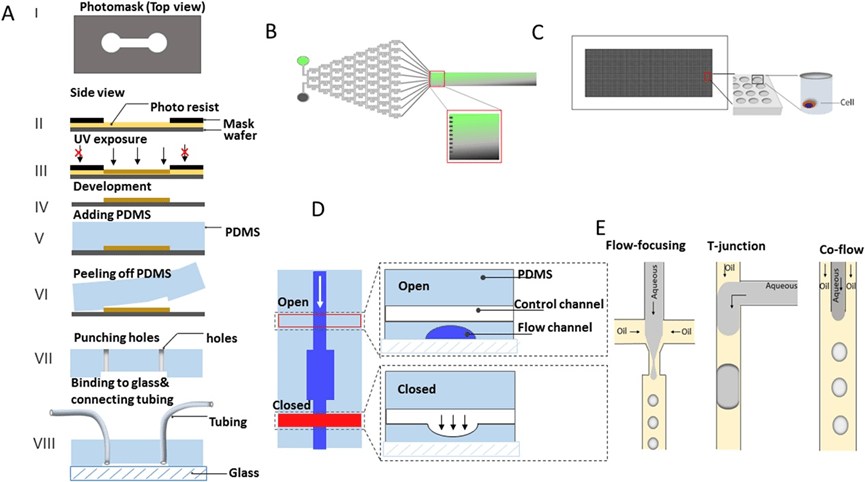
1. 免疫信号
1) 免疫细胞激活和反应
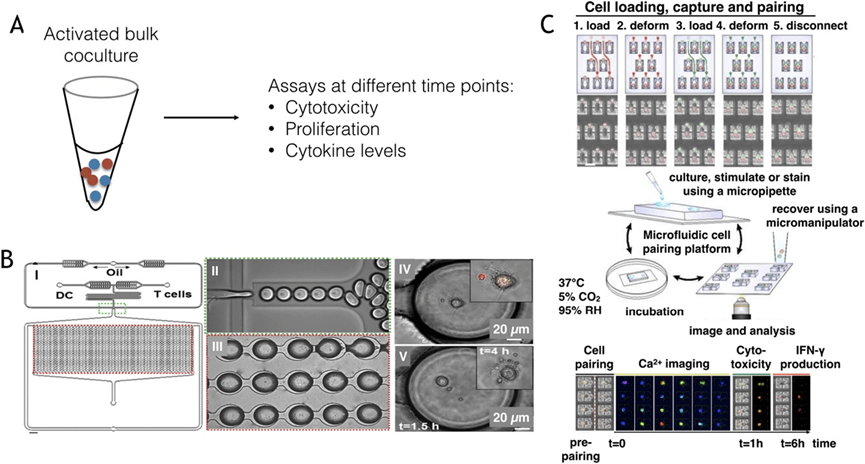
免疫细胞的活化对于其在特定时空中执行功能至关重要,但传统检测方法如ELISPOT和细胞内细胞因子分析受限于参数数量、群体平均效应、荧光标记限制及空间/时间分辨率低,难以全面捕捉异质性和动态过程。
微流控技术为此提供了解决方案,其小体积设计使单细胞分泌的分子快速积累至可检测水平,并可实现多参数实时监测与选择性分离。
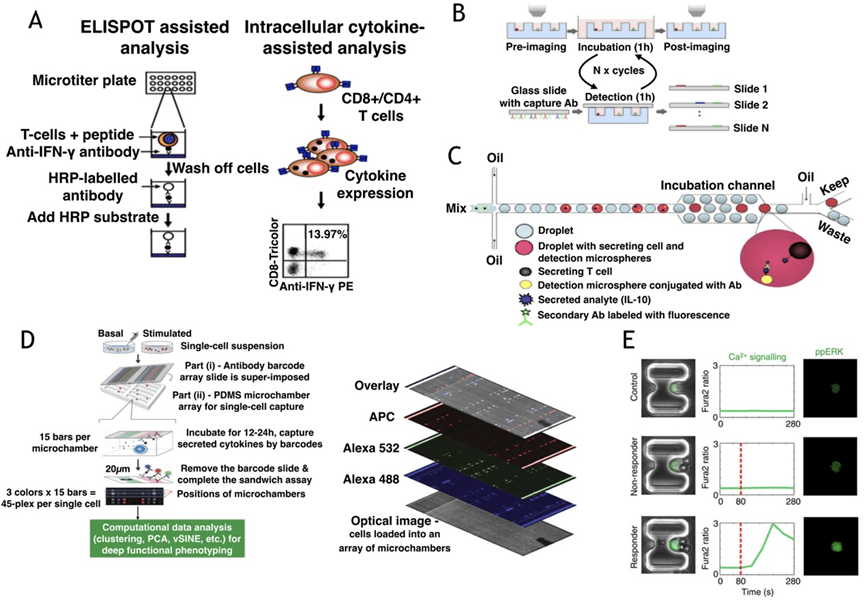
Love实验室利用纳米孔阵列和可更换玻片研究T细胞分泌动力学,揭示免疫反应的确定性特征;
液滴微流控结合荧光分析用于检测IL-10或多种细胞因子,显示出分泌行为的显著异质性;
基于阀门的芯片能在单次实验中检测多达45种蛋白质,发现如MIF等调控因子的重要作用;
此外,细胞捕获用于研究活化初期信号传导,如Ca²⁺流和ERK磷酸化。
Junkin等人开发的自动化微流控平台可实现动态刺激、实时成像及多时点分泌检测,揭示单细胞水平的复杂响应机制及其调控路径,展现了微流控技术在免疫细胞活化研究中的巨大潜力。
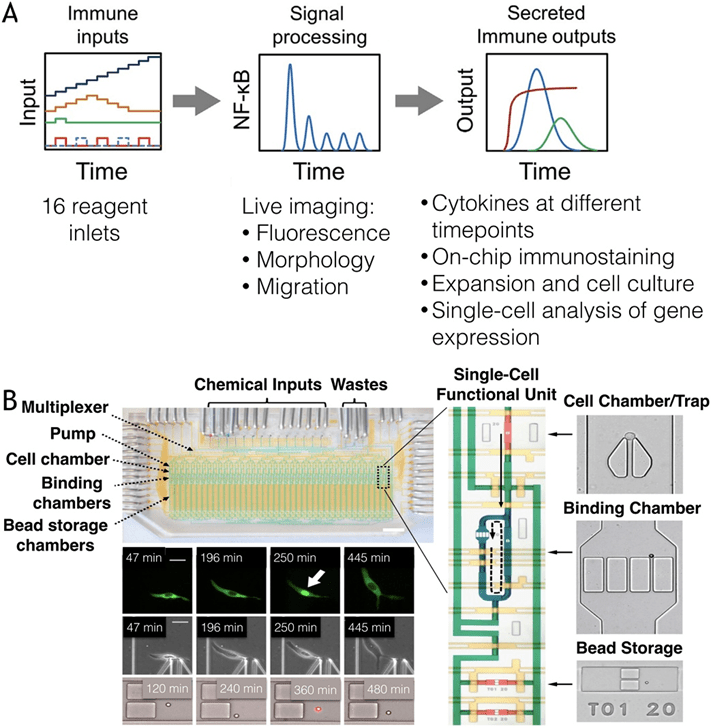
2) 细胞与细胞之间的相互作用
免疫细胞通常通过彼此间的相互作用来启动和执行功能,因此在空间和时间上精准控制这些相互作用并监测其后果对于理解复杂信号事件至关重要。
传统的批量共培养方法无法揭示细胞间的异质性和相互作用的具体动态。
微流控技术的发展,尤其是液滴微流控和细胞捕获系统,使得对免疫细胞相互作用的单细胞分析成为可能。
例如,液滴系统可共封装T细胞与树突状细胞或肿瘤细胞,并通过荧光标记实时监测钙流和细胞杀伤过程,揭示了快速与慢速杀伤表型及其依赖的信号机制。
细胞陷阱则实现了对特定单细胞1:1配对的精准控制,可测量钙信号、表面受体变化及细胞因子表达,进一步揭示了T细胞活化过程中的异质性及其与TCR亲和力的关系,并发现NK细胞的细胞毒性与IFN-γ分泌存在负相关。
尽管目前微流控系统尚无法完全重建体内复杂的免疫生态位,如浆细胞在骨髓中的存活环境,但这些高度受控的体外平台已为免疫细胞间相互作用的深入研究提供了强大工具,有助于我们解析关键事件和信号路径。
2. 免疫细胞迁移
免疫细胞的迁移对其功能至关重要,如T细胞寻找抗原呈递细胞、炎症响应和伤口愈合等。
传统延时成像虽能揭示体内迁移现象,但缺乏操作性,难以解析具体调控机制。
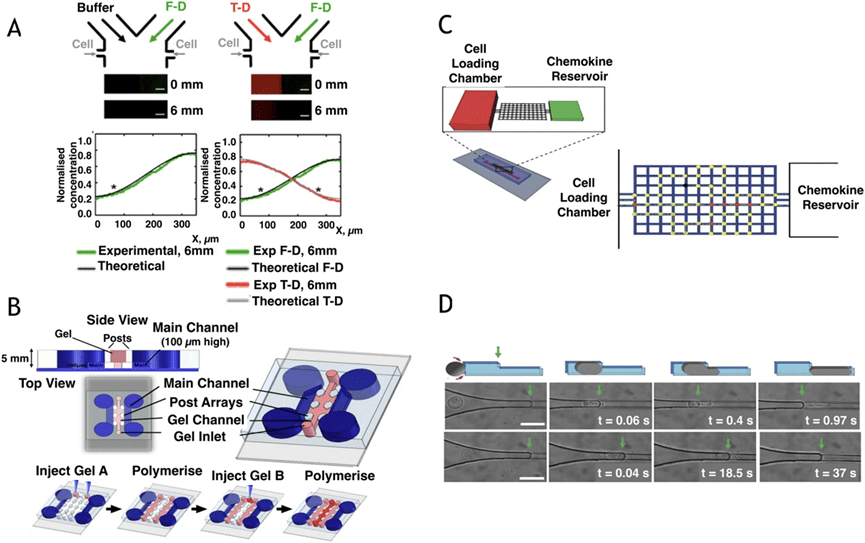
微流控技术通过模拟组织微环境、构建特定几何结构和趋化因子梯度,使研究者能在体外环境中精确操控和观察迁移过程。
例如,研究表明T细胞在CCL19和CXCL12竞争梯度中偏好迁移至CCL19区域,且初始位置影响迁移方向;
树突状细胞在2D和平面与3D基质中对不同细胞因子的反应也不同,显示迁移行为受环境结构调控。
微柱阵列可通过细胞施加的力分析其迁移机制,而3D水凝胶、迷宫芯片等复杂结构可模拟真实组织障碍,研究细胞探索行为和路径选择。
3. 具有所需特性的抗体的表型筛选
自1975年首次描述以来,单克隆抗体已成为研究和治疗中的关键工具,广泛应用于传染病、癌症和炎症治疗,并成为增长最快的新药类别。
尽管杂交瘤技术是传统的抗体筛选方法,但由于其通量有限且依赖细胞永生化,难以覆盖体内庞大的B细胞库。
为了克服这一限制,研究者开发了多种替代技术,包括利用EB病毒、基因重编程以及FACS和表面抗原结合筛选,但这些方法往往耗时、低效或仅限于结合分析。
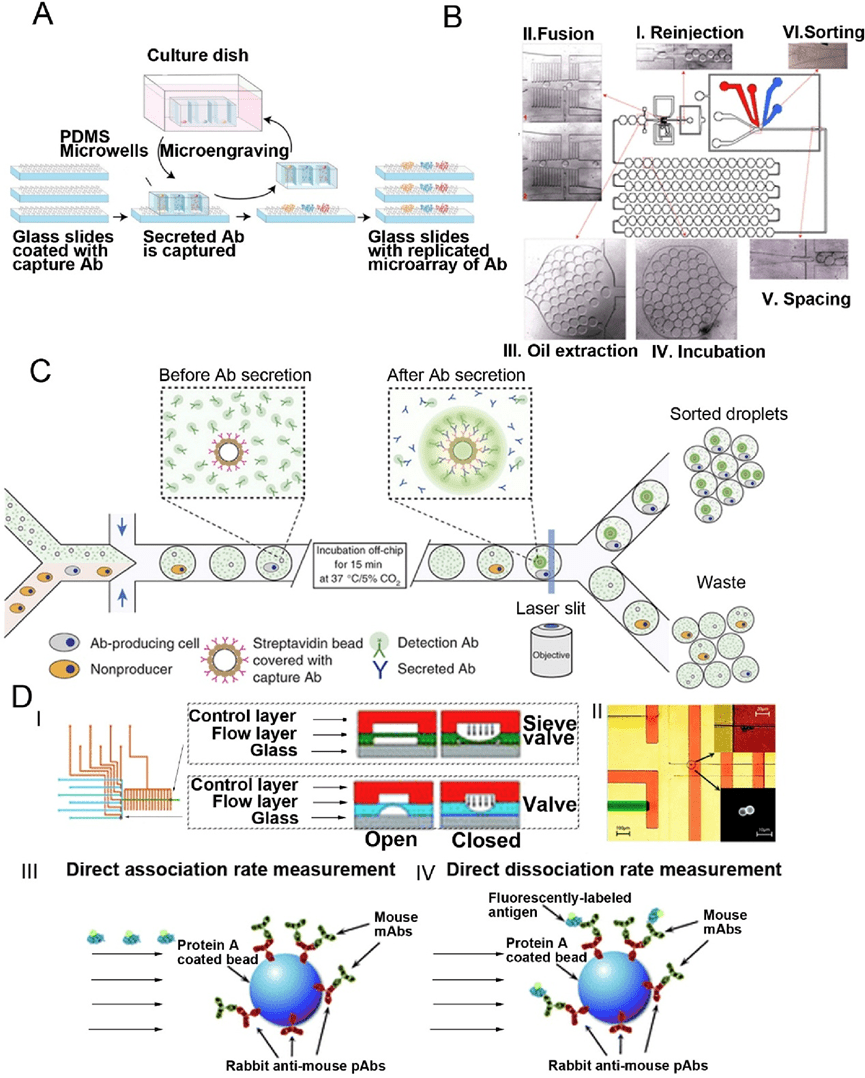
微流控技术则提供了更高通量和灵敏度的解决方案。
纳米孔系统可在皮升体积内检测单个细胞分泌的抗体,并结合荧光抗原快速筛选抗体亲和力;
液滴微流控则通过将细胞封装在油包水液滴中,结合荧光激活分选技术,实现高效、自动化的功能性筛选,甚至可识别超级分泌细胞。
4. 筛选B细胞和T细胞库
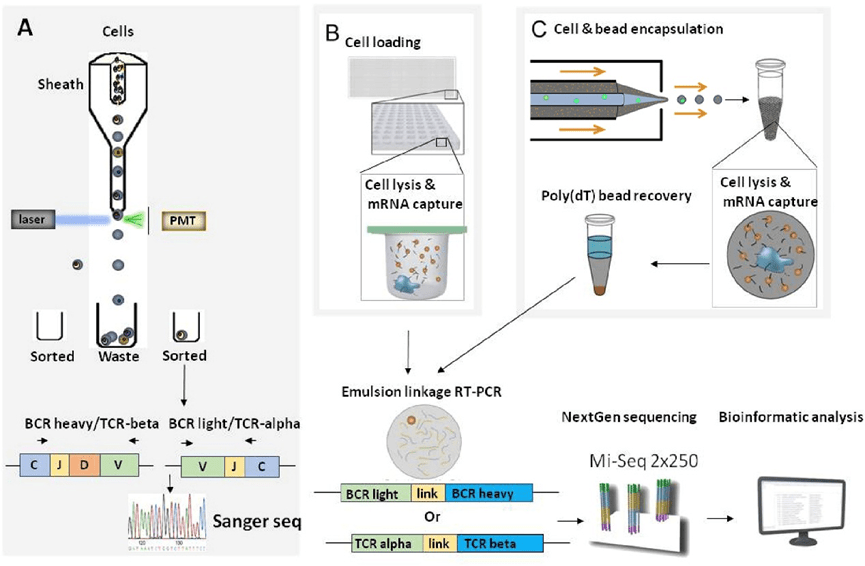
除了在表型水平上筛选B细胞,Ig-seq等基于下一代测序(NGS)的方法也可用于推断抗体结合信息,通过对免疫小鼠骨髓浆细胞(BMPC)的抗体基因进行扩增和测序,可实现高效的VH-VL配对,但轻链多样性较低,需后续验证。
BCR组测序还广泛应用于研究感染、疫苗、衰老、自身免疫等过程,但传统FACS结合单细胞PCR的方法通量有限,难以覆盖数以万亿计的潜在多样性。
随着NGS发展,已可在斑马鱼、人PBMC中解析免疫谱系,但常因无法保持重链与轻链天然配对而受限。
引入细胞条形码、微流控芯片和乳化液滴技术显著提高了通量和配对精度,例如,单芯片可处理逾5×10⁴细胞,乳液法甚至可一次处理逾200万个细胞,并结合酵母展示技术进行抗原筛选。
类似策略也适用于TCR组库分析,因TCR与BCR在结构和功能上类似,对其α-β链的准确配对同样重要。
非微流体乳液RT-PCR方法和微流控技术使数百万T细胞的高通量配对成为可能,且通过引入寡核苷酸抑制剂可有效降低假配对。
结合单细胞转录组分析工具如TraCeR,可将TCR序列与功能状态关联,揭示感染或衰老中T细胞表型变异。
© 2025. All Rights Reserved. 苏ICP备2022036544号-1















