参考文献:Microfluidic devices for studying bacterial taxis, drug testing and biofilm formation – PMC
1. 具有线性通道的微流体装置
1) 单通道设备
趋化作用是微流体装置研究的先驱方向之一,常通过在通道两端分别加入信号分子和细菌形成梯度,观察其运动响应。
例如,Ahmed和Stocker研究了大肠杆菌对趋化剂的响应,发现其速度提高了35%;Stricker等人通过控制氧气扩散研究希瓦氏菌的趋氧行为,发现其运动状态取决于有氧-厌氧转变。
多装置还被用于同时分析多种条件,如研究磁场和流速对大肠杆菌趋磁性的影响,以及木霉菌在高钙条件下的抽搐增强与相关基因表达变化。
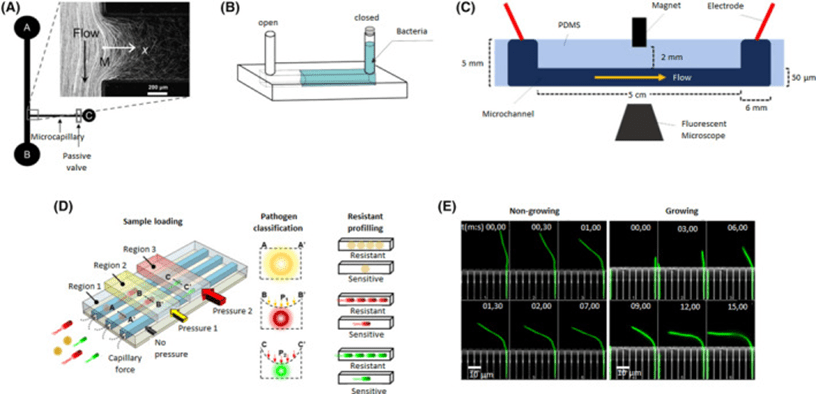
微流体平台也可用于快速药敏测试,检测细菌在抗生素存在下的表型变化,如细胞伸长或原生质球形成。
通过设计适配细菌尺寸的通道,可对其进行电子显微镜观察、单细胞捕获与代际生长研究,发现如大肠杆菌分裂率稳定性及其适应性记忆机制,包括表型记忆与反应记忆。
通过流体动力实验,进一步区分了非生长与生长细胞的力学响应特性。
2) 双通道设备
该类芯片由两个可连接或不连接的通道构成,连接时两个入口的流体汇聚至一个出口,便于比较不同条件下的细菌反应。
Lanning等人利用此装置研究大肠杆菌对α-甲基天冬氨酸和天冬氨酸的趋化性,结果与传统方法一致。
Gashti等人则通过单通道引入唾液链球菌,在中央通道上方形成生物膜,并借助荧光素指示剂观察到pH值因葡萄糖代谢而下降,去除葡萄糖后pH值恢复,重新供给则迅速再次酸化。
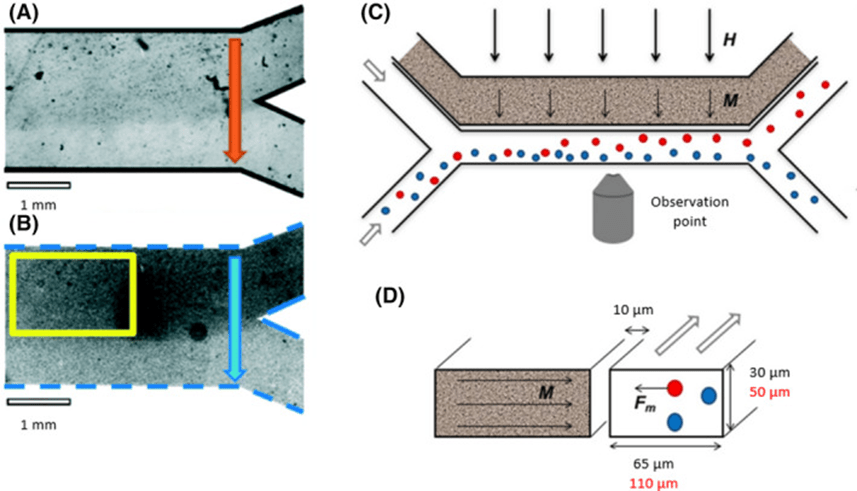
若通道相互独立,不同流体在各自通道内流动,但仍会相互影响,例如格氏磁螺菌在正交磁场作用下被吸引至含磁流体的通道中,显示其趋磁行为。
3) 三通道设备
第三个通道的加入为微流控装置带来更多可能性,可通过侧通道引入信号分子在中央通道中建立梯度,同时保持对照条件,从而分析细菌对梯度的运动响应。
大肠杆菌被广泛用作模型菌,在化学、温度和营养梯度下研究其趋化性与表型变化。
研究发现,l-丝氨酸诱导的迁移最显著,而α-甲基天冬氨酸和天冬氨酸需更高浓度才能引发响应;温度梯度实验显示,大肠杆菌初期趋向高温区,随后因营养梯度而转向低温区域。
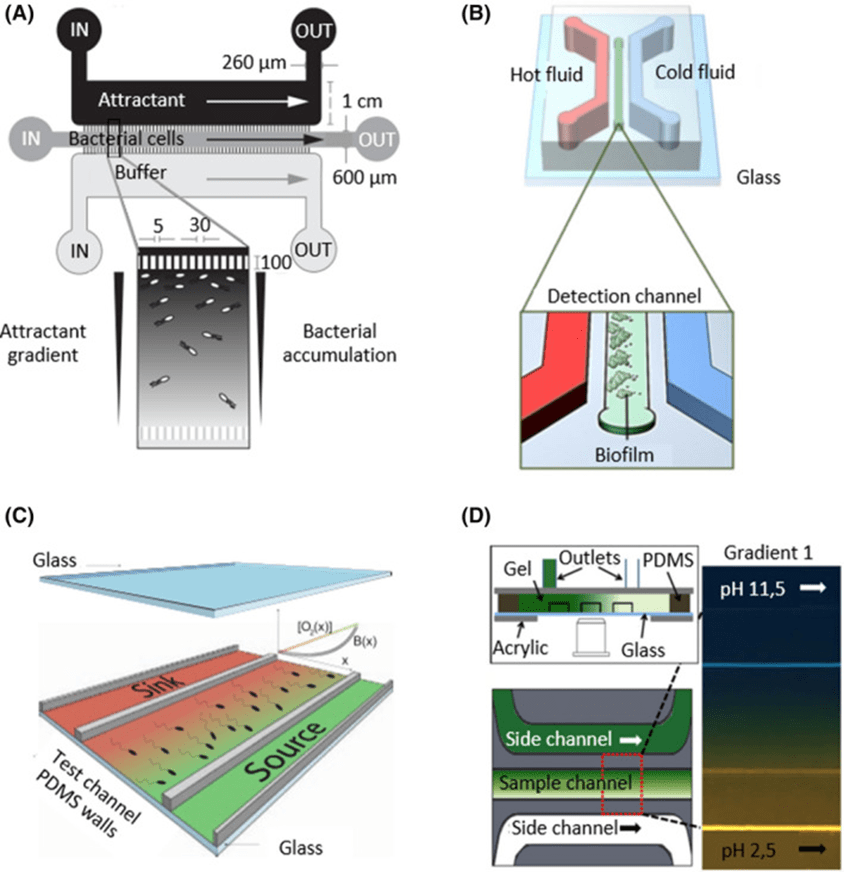
通过构建pH和抗生素梯度,还可测定菌种最适pH值与最小抑菌浓度。
微流控平台也支持多重刺激共存研究,例如磁螺菌可在磁场作用下逆流游动,表现出磁场、水流方向和强度之间复杂的交互响应。
2. 具有混合通道的微流体装置
带有混合通道的微流体装置因其复杂的通道网络设计和制造难度高于前述类型,但能实现精确的扩散混合与微环境控制,常用于构建线性浓度梯度或特定培养条件。
研究发现,大肠杆菌在低浓度L-天冬氨酸下表现出趋化性,而高浓度L-天冬氨酸和Ni²⁺则产生抑制作用,且通过基因敲除实验证实Tar受体能感知这两种物质。
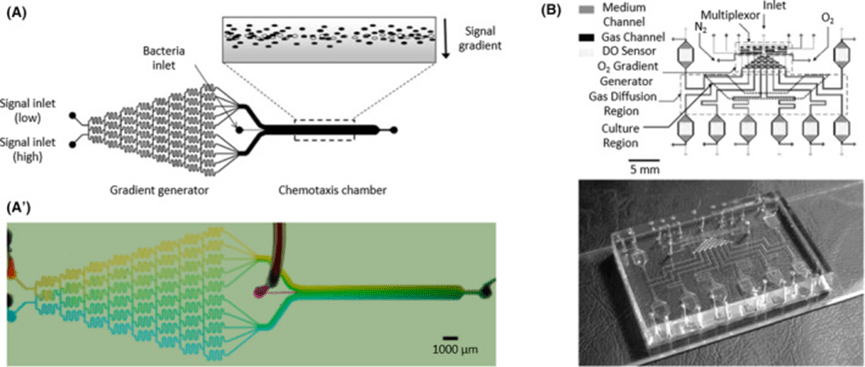
此类装置还可利用氧气混合物创建不同的需氧条件,以最佳方式培养多种细菌,例如高氧培养需氧菌、低氧培养兼性厌氧菌,以及用氮气培养专性厌氧菌,从而实现多种菌种的精细生长调控。
3. 具有多层级的设备
通过将相同或不同设计的多层PDMS层依次粘合,可构建多层微流体装置,用于同时研究多种条件或模拟不同组织的3D环境。
例如,结合温度梯度水路与细菌培养层,研究发现大肠杆菌向高温区迁移并消耗营养后转移至低温区,同时高温使细胞内pH下降、迁移速度减慢。
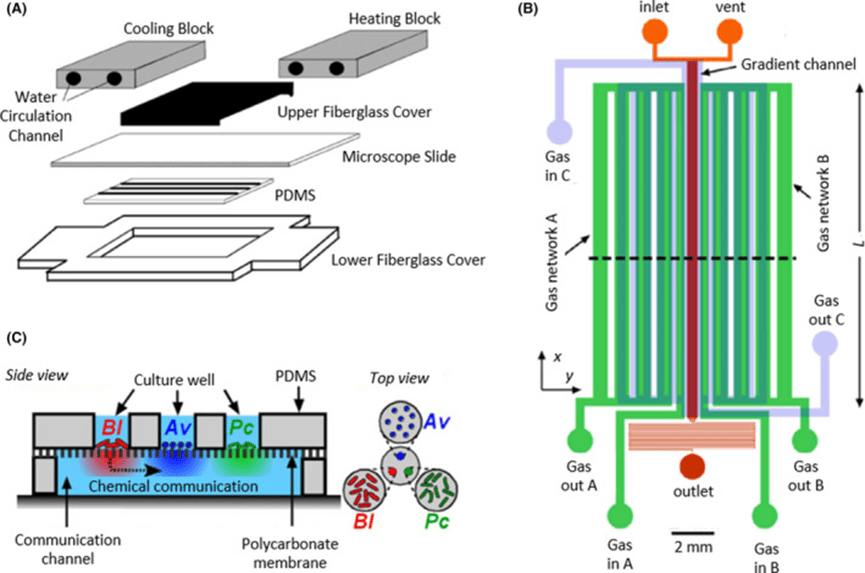
该多层结构还支持细胞间通讯研究,如通过透膜实现不同细菌腔室间的化学信号交流,发现菌落单独培养时种群不稳定,联合作用时种群稳定增长,体现出互养互利关系。
4. 多孔微流体装置
微流体装置的多功能设计支持非平面多孔表面,拓展了研究细菌趋化和流变性的能力。
在多孔介质中,大肠杆菌对α-甲基天冬氨酸的趋化反应更强,显示流动促进了细菌横向迁移;李斯特菌在乙酸梯度下鞭毛运动改变,导致旋转运动。
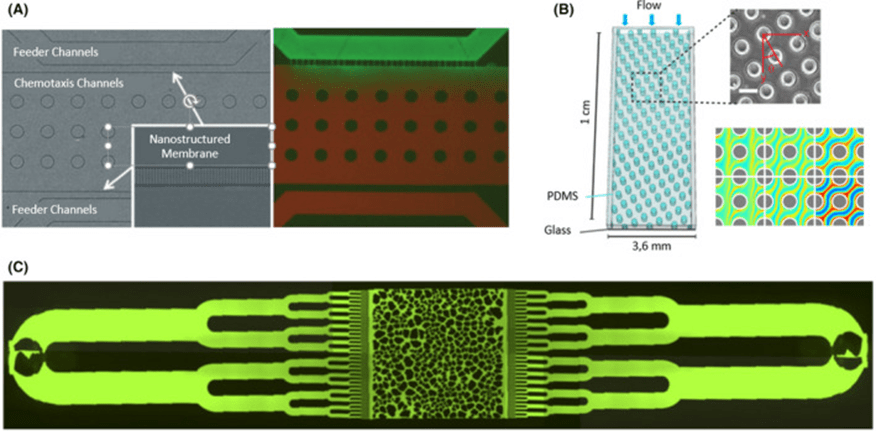
均匀分布的孔洞模拟理想流动,研究发现流体动力学梯度限制了细菌横向扩散,促进平行扩散。
而异质多孔设计模拟土壤环境,发现大肠杆菌在高流量通道附近生长更快,细菌通过优先路径扩展直到阻塞,流体流动被重新导向,促进其他细菌生长;EPS突变体在流动刺激下形成长链,显示细菌群体对流动环境的适应性差异。
5. 拓扑微流体装置
拓扑微流体装置通过非线性通道设计和表面图案展现出复杂结构,用于研究细菌流变性、生物膜形成和迁移行为。
例如,流光形单通道装置揭示螺旋体和铜绿假单胞菌的排列及聚集特性;高度变化的通道影响大肠杆菌的侧向漂移;气泡产生的涡流促进生物膜捕获。
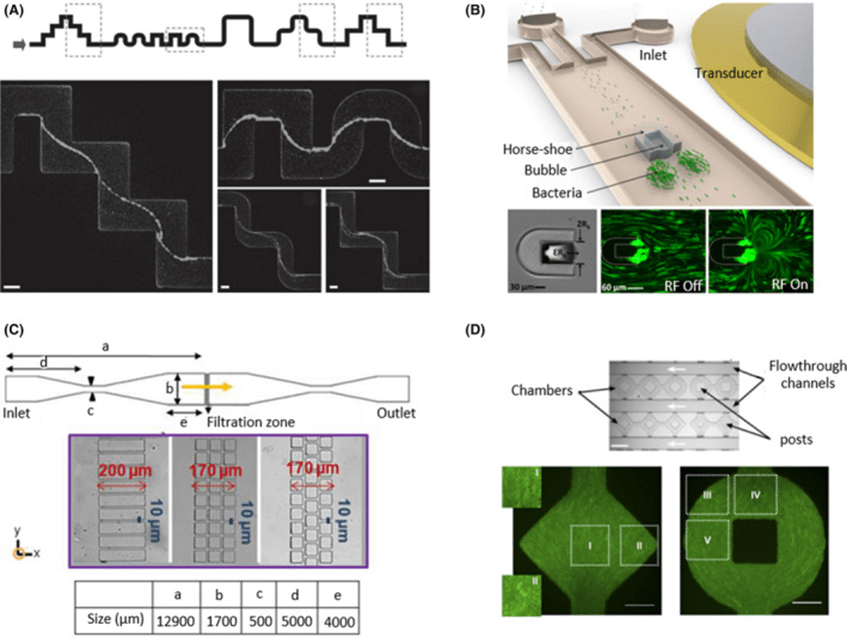
不同表面图案可引导磁螺菌避障和磁场下定向迁移,矩形与方形立柱结构模拟细菌渗透和积聚,非对齐方形结构形成曲折流区促进菌落生长。
不规则表面材料如钛盘模拟口腔植入物环境,展示多种口腔细菌的不同生长模式和生物膜结构,体现微流体装置在模拟复杂微环境中的广泛应用。
6. 液滴微流体装置
基于液滴的微流体技术通过将单个或小群细菌封装在不混溶的两相液滴中,实现细菌的分离和限制,具有高度灵活性和创新性。
液滴通过T型接头或流动聚焦结构生成,包封率受泊松统计控制。
该技术正处于优化阶段,主要用于细菌生长、生物膜形成及毒理和抗生素耐药性测试,如动态培养中需氧菌生长更佳,液滴内稳定培养铜绿假单胞菌等。
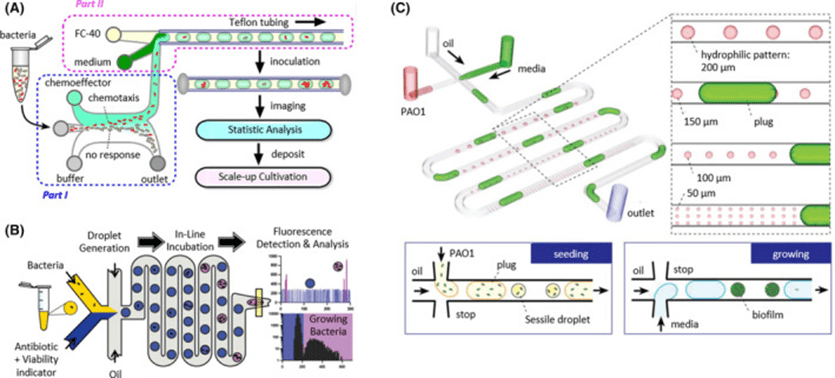
尽管对细菌趋化反应研究较少,但已有装置结合梯度产生和液滴封装,实现细菌趋化能力分析。
液滴微流体平台还能快速检测抗菌物质及分泌物,集成培养与检测于一体,提升效率。
生物膜形成研究显示细菌在液滴边缘聚集并生成孢子,细菌可在亲水图案或油滴周围形成生物膜,模拟复杂微环境。
© 2025. All Rights Reserved. 苏ICP备2022036544号-1















