参考文献:Advances in Microfluidic Single-Cell RNA Sequencing and Spatial Transcriptomics – PMC
1. 单细胞RNA测序技术的进展
单细胞测序(SCS)方法主要包括microplate和微流控两类,其中以Smart-seq2为代表的微孔板方法可获取全长转录本,但通量受限;
而微流控方法通过将细胞分隔至纳升级反应腔中,显著降低交叉污染,并具备高通量、可定制性强等优势。
尤其在微流控装置与高密度微孔阵列的支持下,SCS不仅提升了数据一致性与处理效率,还为多样化生物样本提供了可扩展的分析平台。
1) 基于液滴的单细胞RNA测序方法
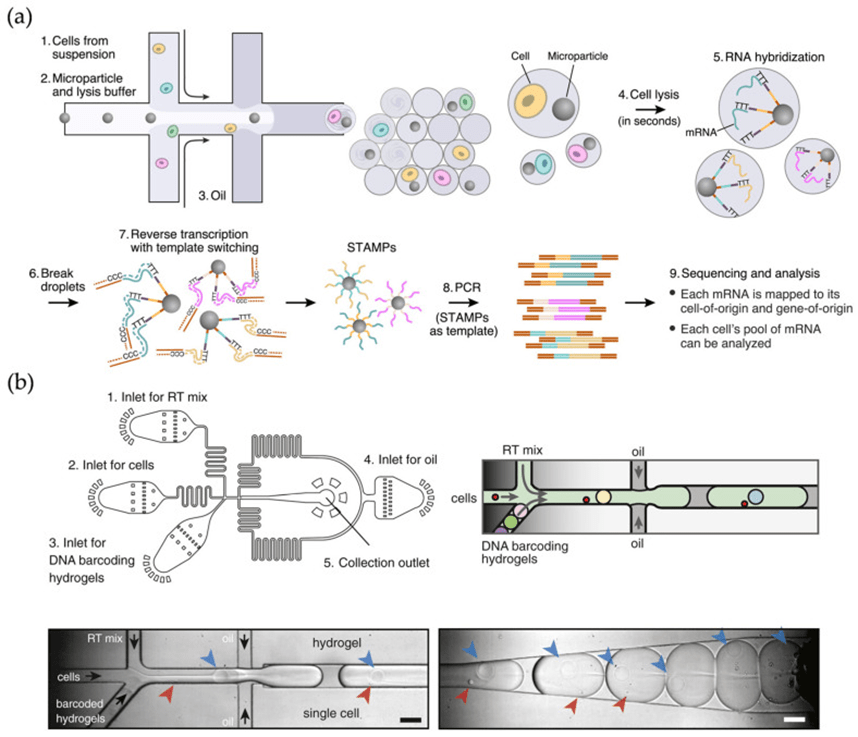
液滴微流控系统通过将细胞悬液分割成由油相包裹的水相液滴,实现单细胞的高通量封装与转录本捕获,目前的液滴式scRNA-seq流程主要包括细胞富集、液滴封装、逆转录及扩增、测序和数据分析五个步骤。
代表性方法Drop-seq和inDrop虽在条形码标记原理上相同,但在封装方式、逆转录环境及扩增策略上存在差异,前者使用刚性珠子统一RT反应并基于Smart-Seq的PCR扩增,灵敏度高但偏倚明显;
后者利用条码化水凝胶微球分别进行RT反应并采用CEL-Seq的线性IVT扩增,扩增偏差更低。
2) 基于微孔阵列的单细胞RNA测序方法
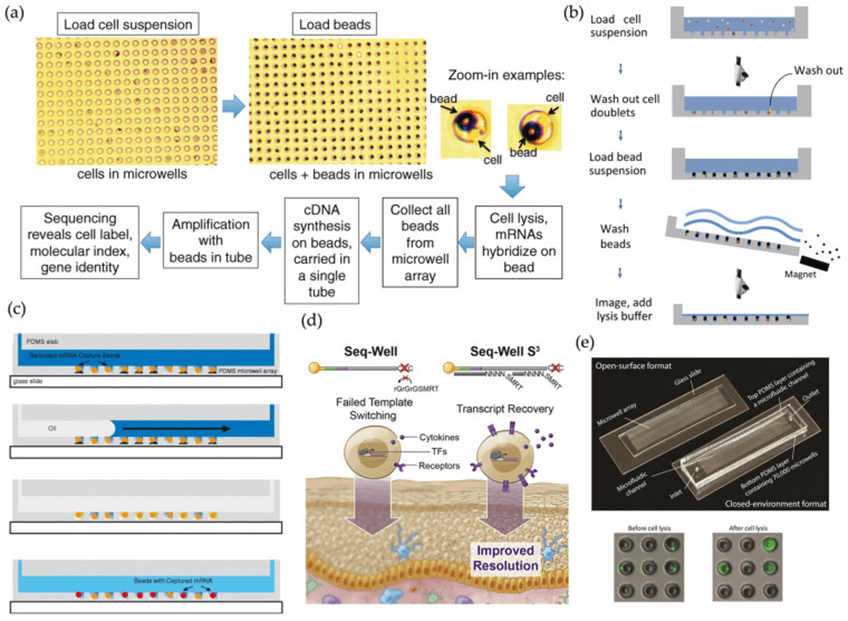
相比于液滴微流控技术,基于微孔阵列的scRNA-seq方法凭借其结构统一、操作简便和成本效益高等优势,可在整体水平上实现更无偏的单细胞测序。
此类方法通过纳升级或皮升级微孔作为独立反应器,利用重力装载单细胞,并在原位完成裂解、RNA捕获和逆转录。
代表性技术如Cytoseq、Microwell-seq和Seq-Well等,通过灵活的封闭策略(如机械密封、油封闭或半透膜)有效降低交叉污染,同时结合固相捕获、磁珠条码化和简化文库构建流程,推动了其在免疫学、神经科学等领域的应用。
3) 基于阀门的单细胞RNA测序方法
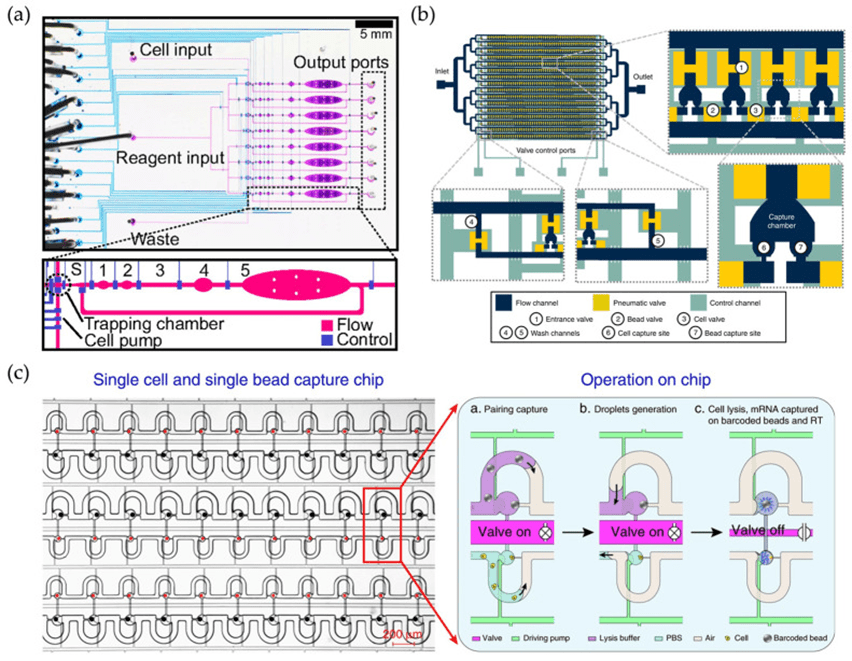
基于阀门的微流控芯片通过调节压力控制弹性PDMS膜阀门的开合,实现对单细胞的精准分离、捕获与处理,具备高灵敏度、高通量和低污染等优势。
代表性平台如Streets团队的自动化芯片、Hydro-Seq及Paired-seq等,通过优化阀门设计和通道结构,可有效排除杂细胞及游离RNA,适用于循环肿瘤细胞(CTCs)等珍贵样本的纯化与分析。
同时,商用平台Fluidigm C1支持多种文库构建协议,能够获取全长转录本,便于在临床样本中进行高质量表达谱分析。
4) 单细胞多组学分析
生物学中心法则揭示了DNA、RNA与蛋白质之间的相互关系,单一组学难以全面反映细胞功能与状态,因此单细胞多组学技术应运而生,以同时捕捉细胞在时间和空间维度上的动态变化。
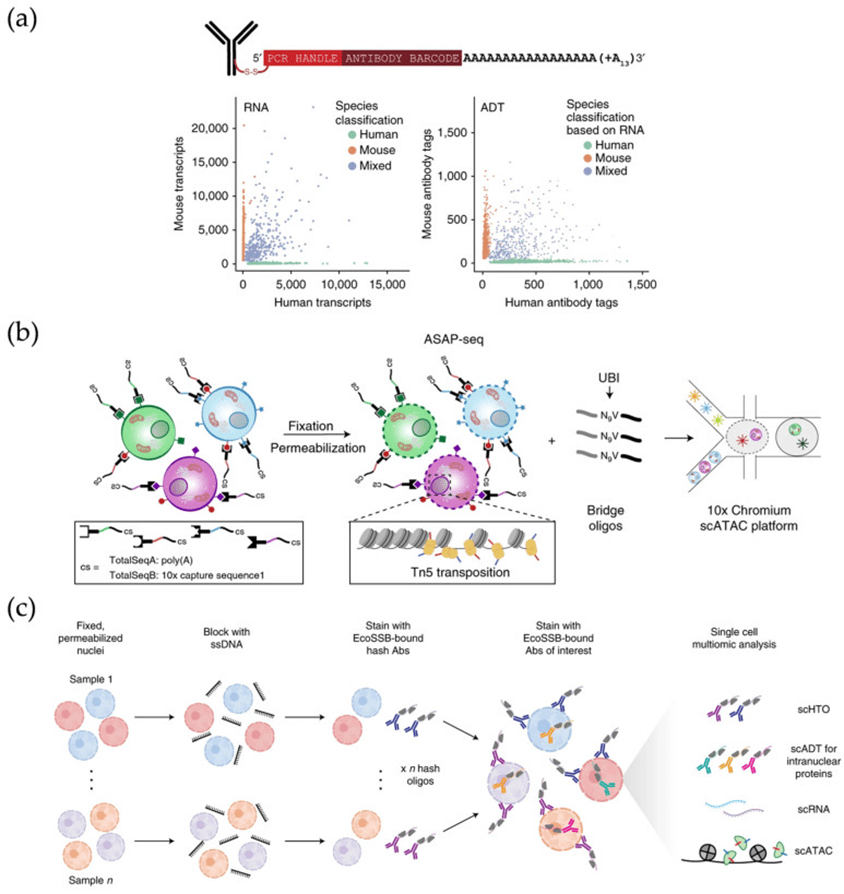
微流控平台凭借其对单细胞精确操控的能力,成为整合转录组、蛋白质组、基因组乃至表观组学的理想工具。
如CITE-seq和REAP-seq可同时读取转录本与蛋白表达信息,适配体替代抗体进一步降低了成本;ASAP-seq与NEAT-seq则实现了对染色质可及性、转录本和蛋白的三重检测。
通过集成多层次数据,这些方法不仅能揭示细胞异质性、疾病进程及免疫调控机制,还为筛选潜在疾病标志物与关键调控因子提供了全新路径。
2. 空间转录组学的进展
尽管单细胞测序(SCS)能够揭示细胞间异质性,但无法解析细胞间及其与微环境的空间关系。
空间分辨转录组学(SRT)技术通过成像、激光显微切割(LCM)和测序三类方法,为研究组织发育、稳态与疾病机制提供了新的视角。
其中,测序类SRT因具备非偏倚、高通量和低错误率等优势而被广泛应用。
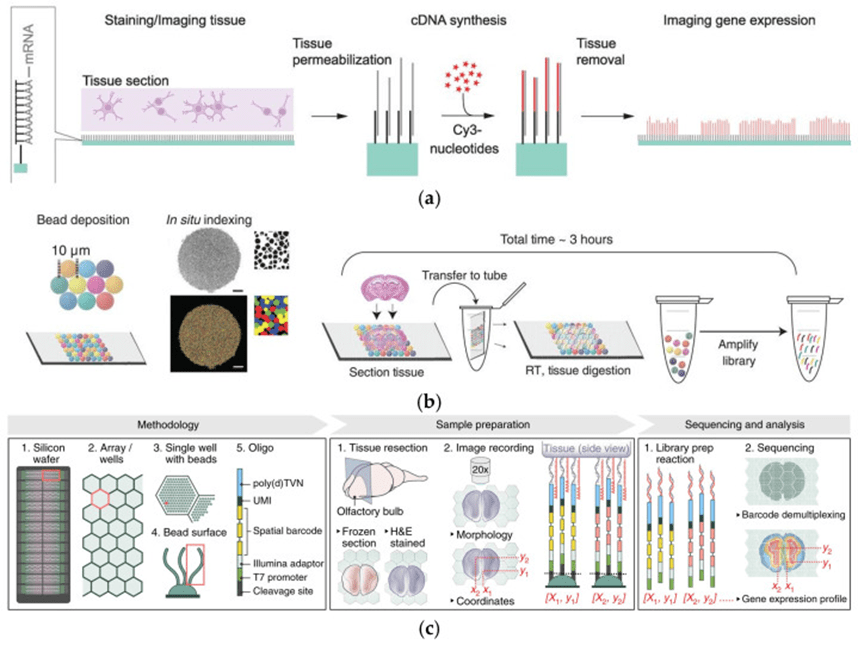
1) 基于阵列的空间转录组学(SRT)方法
基于阵列的空间转录组学技术通过表面或微珠捕获polyA RNA,在保留空间信息的同时实现转录组测序,广泛应用于组织异质性研究。
表面捕获方法如ST技术和其商业化平台Visium,通过在玻璃片上修饰捕获探针并赋予空间条形码,已实现从200微米至100微米的分辨率提升,后续如SM-Omics与SPOTS更整合蛋白分析以增强多组学能力。
微珠捕获方法如Slide-Seq和HDST则使用直径分别为10微米和2微米的磁性微珠构建高密度阵列,虽具备近单细胞级分辨率,但由于捕获效率不足及条形码映射到相邻切片而非当前组织,仍面临数据不足和定位偏差等挑战,特别在处理肿瘤等高度异质性样本时限制明显。
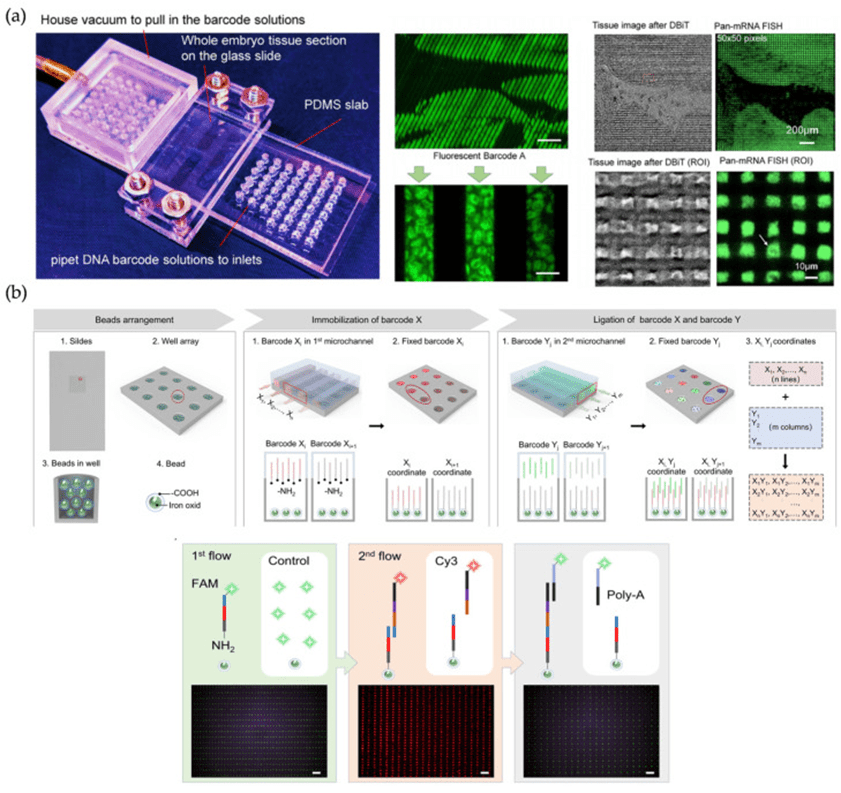
2) 基于微通道的空间转录组学(SRT)方法
基于微通道的空间转录组学(SRT)方法以其可调节的空间条形码分辨率和强大的多组学集成能力,为组织内生物调控网络的精细解析提供了新视角。
代表性技术DBiT-seq通过两块垂直交叉的PDMS微流控芯片在组织切片上构建空间像素网格,像素分辨率可达10微米,支持蛋白质组、转录组等多组学数据在同一组织上的高分辨率共解析,且兼容FF和FFPE组织切片。
该方法不仅适用于形态结构对齐的光学成像分析,还可通过修饰顺磁颗粒优化通道稳定性,提升组织适应性。
因此,以DBiT-seq为代表的微通道SRT策略具备良好的通用性和可扩展性,为多维空间生物信息的高精度捕获提供了强大支持。
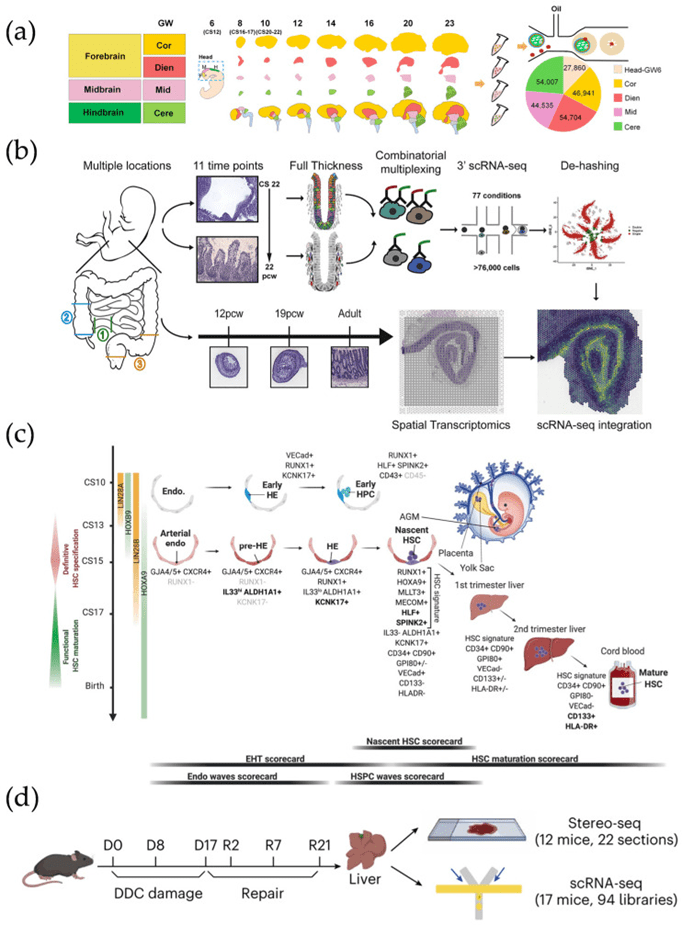
3) 时空转录组
时空转录组技术通过结合空间位置信息与伪时间分析,能够动态捕捉细胞在发育、迁移及分化过程中的基因表达变化,为揭示细胞命运和生物调控机制提供了强有力的手段。
依托微流控平台在分辨率调节与高通量采集方面的优势,该技术可实现多时间点、多组织尺度的非偏倚分析,尤其适用于哺乳动物胚胎如小鼠和人类在器官发生过程中的研究。
诸如Slide-seqV2和Stereo-seq等先进平台已成功构建了小鼠大脑与眼部等器官的发育轨迹,甚至实现了人脑跨时间点的空间发育图谱描绘。
结合单细胞测序(SCS)与空间转录组(SRT),研究人员还揭示了肠道、四肢及造血干细胞(HSC)等关键系统的时空调控路径,并通过Visium等平台精确定义HSC的起源与调控因子。
Site Search
Recommendations
© 2025. All Rights Reserved. 苏ICP备2022036544号-1















