参考文献:Emerging biotechnologies for engineering liver organoids – PMC
肝脏类器官通过形成结构有序、功能多样的3D结构,克服了传统2D培养和动物模型的局限,成为疾病建模、药物筛选及组织工程的重要工具。
其利用原代肝细胞或iPSCs在Matrigel等支架中培养,但面临变异性大、成熟度不足等问题。
工程化解决方案采用天然/合成水凝胶或脱细胞支架,结合微流控、3D生物打印等技术提升可控性与一致性,而基因工程进一步通过改造干细胞定制类器官功能,推动其向更复杂、更仿生的方向发展。
1. 工程化肝脏类器官的基质材料
细胞外基质(ECM)及其模拟物在肝类器官培养中发挥关键作用,提供三维支撑并调控细胞行为。
天然水凝胶(如Matrigel、胶原蛋白、壳聚糖等)具有良好生物活性但存在异质性,而改性材料(如GelMA)通过可调性能优化培养环境。
合成水凝胶(如PEG、PIC)可精准调控力学和生化特性,经RGD或层粘连蛋白修饰后能媲美甚至超越Matrigel。
脱细胞支架保留天然ECM的完整结构和生物信号,支持复杂类器官构建,但需解决批次变异和免疫原性问题。
2. 工程化技术在肝脏类器官中的应用
传统类器官培养方法(如Matrigel穹顶培养、悬滴培养等)存在操作繁琐、批次差异大的局限性。
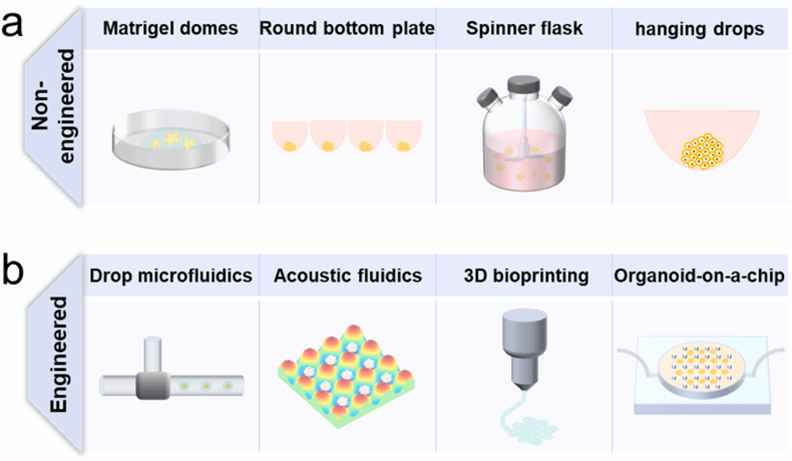
为突破这些瓶颈,新兴工程化技术通过自动化与标准化工艺,显著提升了类器官生产的规模化和均一性。
1) 液滴微流控技术
液滴微流控技术通过调控流体参数可高效制备尺寸均一的水凝胶微胶囊,为肝类器官培养提供理想3D平台。
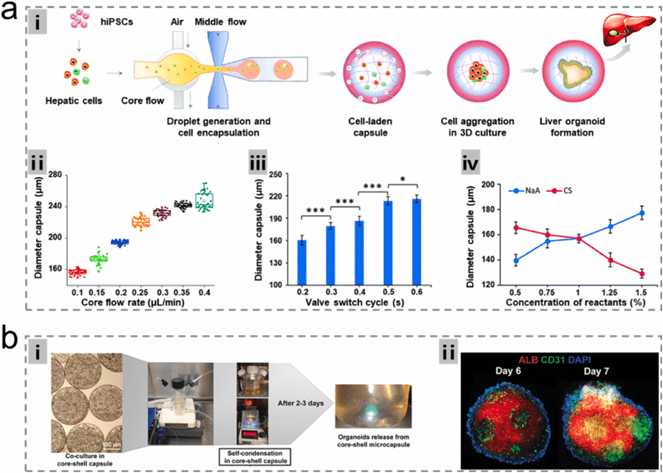
例如,将hiPSC来源的肝前体细胞与支持细胞封装在可降解肽基水凝胶中,可自组装形成具有胆管和血管网络的复杂肝类器官。
该技术实现了类器官的规模化、标准化生产,克服了传统方法的可控性与可重复性难题。
2) 声学流体学
声学流体技术利用声场快速诱导细胞聚集,相比传统方法显著提升效率。
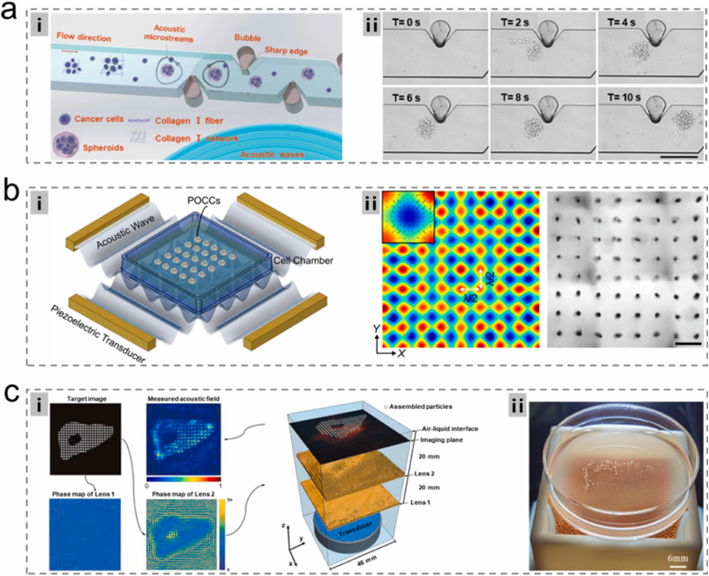
通过胶原蛋白辅助或压电换能器阵列,可在秒级形成稳定细胞聚集体,并成功应用于乳腺肿瘤和肝类器官构建。
中科院团队开发的全息声学镊子技术制备的肝细胞球体展现出优越功能,虽研究尚处早期,但为类器官标准化生产提供了新思路。
3) 3D生物打印
3D生物打印技术为肝类器官构建提供了高效精准的新方法,通过微阵列打印、挤出式打印等技术实现细胞和类器官的空间可控沉积,显著提升生产效率和功能性。
该技术不仅能批量制备均一性高的类器官阵列(如1分钟完成前肠细胞-Matrigel打印),还能设计具有优化扩散性能的复杂结构(如200-400μm孔径肝构造体)。
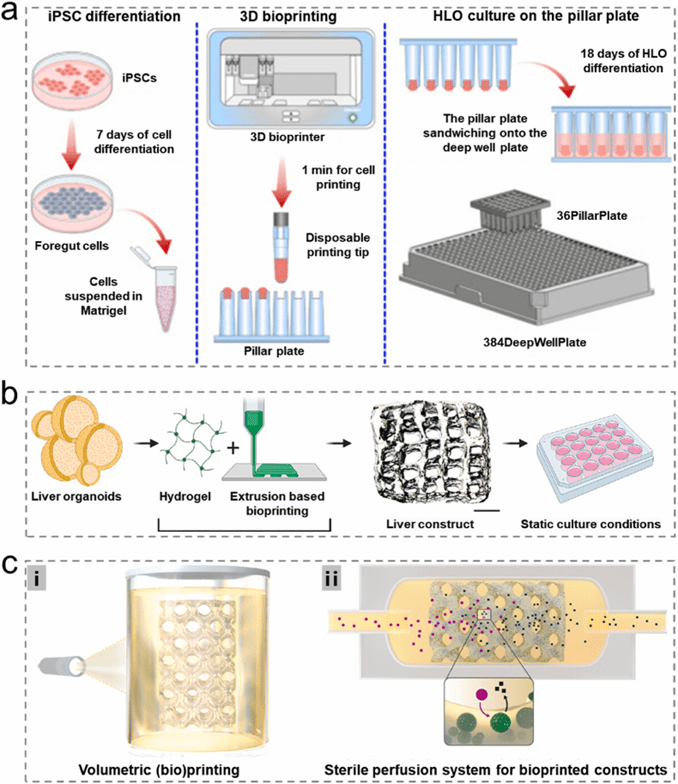
体积生物打印等非挤出式方法更实现了完整类器官的3D支架快速嵌入(20秒完成),保持良好活性和代谢功能。
虽然仍需解决打印分辨率、细胞损伤等问题,生物打印技术正在推动肝类器官向更高复杂性、生理相关性和应用多样性发展。
4) 芯片上的类器官
微流控芯片技术通过精密设计的流体通道和动态培养环境,该技术不仅能实现类器官的高效培养与分化(如3D微柱芯片系统使肝标志物表达提升),更通过多器官集成开创了全新研究维度——如肝脏-心脏类器官芯片可评估药物代谢毒性,肝脏-胰岛系统能模拟生理级葡萄糖调控。
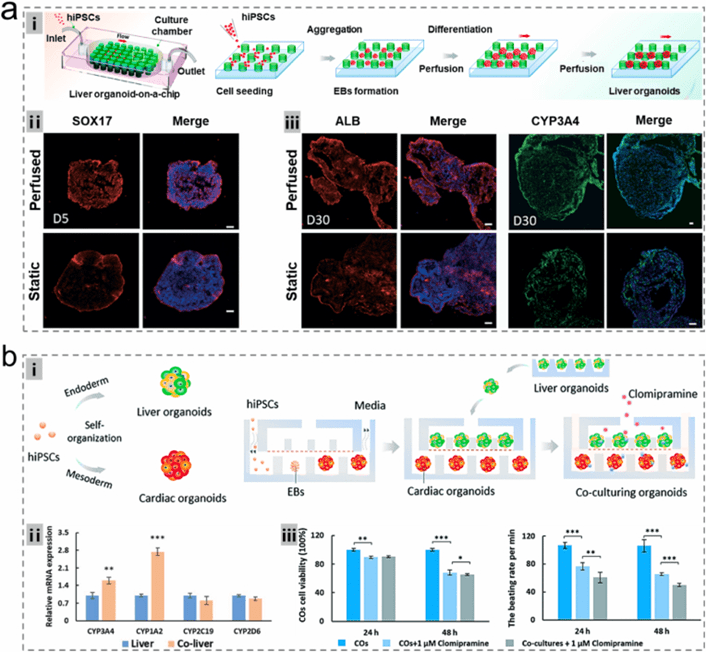
这些芯片平台结合微流控的精准流体控制优势(剪切应力、营养输送)和多器官交互特点,显著提升了药物测试的可靠性和生理相关性,为复杂生物过程研究和精准医疗提供了强大工具。
3. 工程化肝脏类器官的应用
1) 疾病建模
通过基因编辑(如CRISPR介导的BAP1突变)或病理微环境诱导(如脂肪酸暴露模拟脂肪肝),类器官能精准再现非酒精性脂肪肝、胆管癌等疾病的病理特征。
患者来源的iPSCs类器官保留了遗传背景,如Alagille综合征模型中胆管发育异常,经基因修复后可逆转表型。
结合微流控芯片的动态培养,该类器官平台不仅能解析疾病机制(如c-Myc致癌作用),还能评估基因治疗(如ASS1转导纠正氨代谢)和抗纤维化药物的效果。
2) 药物筛选
肝类器官技术正革新药物毒性评估体系,通过微流控3D打印等技术实现高通量、标准化药物筛选(如奥沙利铂肝毒性节律研究)。
多器官芯片平台突破单一器官局限,如肝脏-心脏-肺芯片揭示卡培他滨代谢产物对多器官的级联毒性,或六器官系统追踪异环磷酰胺代谢引发的神经毒性。
这种仿生系统不仅能预测药物肝毒性,更能模拟全身代谢网络,为临床前研究提供更精准的毒性评估模型,显著提升新药研发效率与安全性预测能力。
3) 再生医学
研究表明,水凝胶封装(如藻酸盐)的类器官可有效避免免疫排斥和畸胎瘤风险,在动物模型中显著提高存活率;而结合脱细胞支架血管结构的再细胞化技术,更实现了长达28天的功能性移植。
尽管临床转化仍需解决血管重建等关键问题,但现有成果——如Lgr5+类器官挽救Fah−/−小鼠、3D打印类器官延长肝衰竭模型生存期等,已为突破供体短缺瓶颈提供了革命性路径,标志着再生医学迈向临床应用的重大进展。
© 2026. All Rights Reserved. 苏ICP备2022036544号-1













